题目内容
6.较多量的轻金属盐如饱和的Na2SO4溶液可使蛋白质产生盐析.分析 盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程,据此解题.
解答 解:向蛋白质溶液中加入饱和Na2SO4溶液,可以降低蛋白质的溶解度,该过程是蛋白质的盐析,故答案为:盐析.
点评 本题考查有机化学基本概念,题目难度不大,注意对基础知识的理解掌握与识记.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
14.标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是( )
| A. | 体积 ④<①<②<③ | B. | 密度 ①<④<③<② | ||
| C. | 质量 ④<①<③<② | D. | 氢原子数 ②<④<③<① |
1.已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol/L)变化
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.第4~5min之间,改变的条件是增大氢气的浓度,C2>0.104 (填“>”、“=”、“<”).T℃时该化学反应的平衡常数是0.5.
②已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 是多少?(请写出计算过程,无过程结果不给分)
③397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol/L)变化
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
②已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 是多少?(请写出计算过程,无过程结果不给分)
③397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
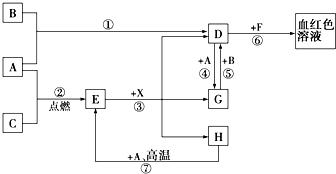 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去).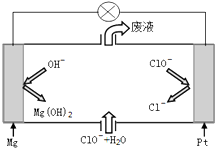 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用. 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题: (1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1
(1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1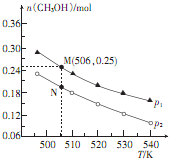 以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法