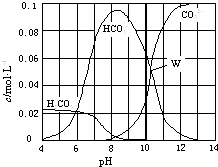
题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是: ①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJmol﹣1
B.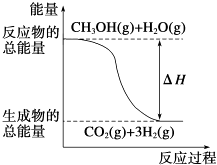 反应①中的能量变化如图所示
反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
【答案】D
【解析】解:A、反应②生成氢气,不符合燃烧热的概念,故A错误; B、图中表示的是放热反应,而反应①是吸热反应,图象不符合,故B错误;
C、据反应①②可知,CH3OH转变成H2的过程不一定要吸收能量,故C错误;
D、反应②气态甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol液态 CH3OH充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ,故D正确;
故选D.
A、燃烧热是指1mol可燃物完全燃烧生成稳定的化合物时放出的热量;
B、反应①是吸热反应,反应物能量小于生成物;
反应①是吸热反应,反应②是放热反应,对比反应的热化学方程式可知等物质的量的气态水能量低于氧气的能量;
C、据反应①②分析;
D、依据反应②甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol CH3OH气态变化为液态放热,充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目