题目内容
醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.醋酸溶液中:c(H+)>c(CH3COO-)>c(OH-) |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
| C.等体积、等物质的量浓度的醋酸与氢氧化钠溶液混合:c(Na+)=c(CH3COO-) |
| D.中和等体积、等物质的量浓度的CH3COOH溶液和HCl溶液所消耗的NaOH物质的量相等 |
AD
解析试题分析:醋酸溶液中醋酸能部分电离出醋酸根离子和氢离子,水也能微弱地电离出氢离子和氢氧根离子,但前者的电离程度大于后者,所以该溶液中c(H+)>c(CH3COO-)>c(OH-),故A正确;碳酸氢钠能完全电离出钠离子和碳酸氢根离子,水也能微弱地电离出氢离子和氢氧根离子,但前者的电离程度大于后者,碳酸氢根离子既能电离又能水解,水电离出的氢离子有一部分没有被消耗,另一部分氢离子与水解的碳酸氢根离子结合生成H2CO3,水电离出的氢氧根离子也有一部分没有被消耗,另一部分与碳酸氢根离子中和生成碳酸根离子,和水,即H++ HCO3- H2CO3、OH-+ HCO3-
H2CO3、OH-+ HCO3- CO32-+H2O,则水电离出c(H+)=溶液中的c(H+)+c(H2CO3),水电离出的c(OH-)=溶液中的c(OH-)+c(CO32-),由于H2O
CO32-+H2O,则水电离出c(H+)=溶液中的c(H+)+c(H2CO3),水电离出的c(OH-)=溶液中的c(OH-)+c(CO32-),由于H2O H++OH-中各物质的系数之比等于物质的量浓度之比,则由水电离出的c(OH-)= 水电离出的c(H+),即溶液中的c(H+)+c(H2CO3)= 溶液中的c(OH-)+c(CO32-),故B错误;由于n=c?V,则混合前氢氧化钠的物质的量等于醋酸的物质的量,则二者恰好完全中和,得到溶液是醋酸钠溶液。醋酸钠是强碱弱酸盐,能水解,导致混合溶液显碱性,则溶液中c(OH-)>c(H+),混合溶液中只有醋酸根离子、钠离子、氢离子和氢氧根离子,根据电荷守恒原理,则溶液中c(Na+)+ c(H+)= c(OH-)+ c(CH3COO-),由于c(OH-)>c(H+),则溶液中c(Na+)>c(CH3COO-),故C错误;c1? V1=c2?V2,则醋酸的物质的量与氯化氢相等,由于CH3COO+NaOH=CH3COOH+H2O、HCl+NaOH=NaCl+H2O,其中各物质的系数之比等于物质的量之比,则两反应完全中和时消耗NaOH的物质的量相等,故D正确。
H++OH-中各物质的系数之比等于物质的量浓度之比,则由水电离出的c(OH-)= 水电离出的c(H+),即溶液中的c(H+)+c(H2CO3)= 溶液中的c(OH-)+c(CO32-),故B错误;由于n=c?V,则混合前氢氧化钠的物质的量等于醋酸的物质的量,则二者恰好完全中和,得到溶液是醋酸钠溶液。醋酸钠是强碱弱酸盐,能水解,导致混合溶液显碱性,则溶液中c(OH-)>c(H+),混合溶液中只有醋酸根离子、钠离子、氢离子和氢氧根离子,根据电荷守恒原理,则溶液中c(Na+)+ c(H+)= c(OH-)+ c(CH3COO-),由于c(OH-)>c(H+),则溶液中c(Na+)>c(CH3COO-),故C错误;c1? V1=c2?V2,则醋酸的物质的量与氯化氢相等,由于CH3COO+NaOH=CH3COOH+H2O、HCl+NaOH=NaCl+H2O,其中各物质的系数之比等于物质的量之比,则两反应完全中和时消耗NaOH的物质的量相等,故D正确。
考点:考查溶液中粒子浓度大小关系,涉及电离程度的判断、质子守恒原理、酸碱中和反应、盐类水解、电荷守恒定律、强电解质、弱电解质等。

下列叙述正确的是
| A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| B.2 L 0.05 mol·L-1乙酸溶液中H+数为0.1NA(NA为阿伏加德罗常数) |
| C.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| D.常温下在pH=1的溶液中Na+、NH4+、[Al(OH)4]-、SO42-可以大量共存 |
以0.1000 mol·L-1 NaOH溶液滴定c mol·L-1,某弱酸HA溶液,其滴定曲线如图所示,下列说法正确的是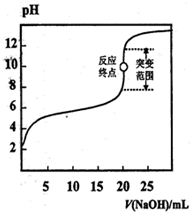
| A.可用甲基橙作滴定指示剂 |
| B.指示剂指示的滴定终点就是反应终点 |
| C.突变范围的大小与酸的强弱及酸的浓度有关 |
| D.滴定时氢氧化钠溶液盛放在带活塞的滴定管中 |
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
常温下,pH=8~9的Na2SO3溶液中存在:SO32ˉ+H2O HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是
| A.加入少量NaOH固体,Kw增大 |
| B.c(OHˉ)= c(HSO3ˉ)+2 c(H2SO3)+ c(H+) |
| C.c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ) |
| D.加入稀盐酸,c(HSO3ˉ)减小 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
已知25℃时,AgCl的溶度积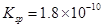 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有 |
C.温度一定时,当溶液中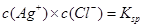 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
