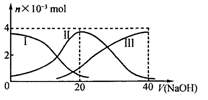
题目内容
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
AD
解析试题分析:CH3COOH与CH3COONa混合溶液中含有CH3COO—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(CH3COO-)+ c(OH-) = c(Na+) + c(H+),故A选项正确;碳酸钠是强酸弱碱盐,碳酸根离子分步水解,水电离出的氢离子浓度与氢氧根离子浓度相等,由于CO32—+H+=HCO3—、CO32—+2H+=H2CO3中生成物与被消耗氢离子的系数之比等于浓度之比,则c(H+)水= c(H+)+c(HCO3—)+2c(H2CO3),c(OH-)水= c(OH-),所以c(OH-) = c((H+) + c(HCO3-) + c(H2CO3),故B选项错误;硫酸铵的化学式为(NH4)2SO4,则铵根离子是硫酸根离子的两倍,虽然(NH4)2SO4是强酸弱碱盐,铵根离子少部分水解,但是溶液中铵根离子浓度仍大于硫酸根离子浓度,即溶液中c(NH4+)>c(SO42-)>c(H+)> c(OH-),故C选项错误;KCl与NaHS的物质的量都是1mol,则溶液中n(K+) =n(Na+),由于氯化钾和水中都无硫元素,NaHS是强碱弱酸酸式盐,其电离出的HS—既能水解又能电离,根据硫元素守恒可知,n(Na+)= n(S2-)+n(HS-)+n(H2S),根据物料守恒原理可得:n(K+)=n(S2-)+n(HS-)+n(H2S)=1mol,故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及酸与盐溶液中电荷守恒关系式、盐溶液中质子守恒关系式、盐溶液中离子浓度大小顺序、盐与盐溶液中物料守恒关系式等。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案25℃时,在20 mL 0.1 mol·L-1盐酸中逐滴加入0.2 mol·L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是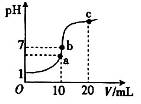
| A.在b点,盐酸与氨水恰好完全中和 |
| B.在b点:c(H+)=c(OH-),c(NH4+)=c(Cl-) |
| C.在a点:c(Cl-)> c(NH4+)> c(H+)> c(OH-) |
| D.在c点:c(NH4+)+ c(NH3·H2O)="2" c(Cl-) |
常温下,0.1mol/L氨水溶液中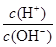 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
| A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L |
| B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+) |
| C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
下列说法正确的是
| A.可用盐析法分离NaCl溶液和淀粉胶体 |
| B.0.1mol·L-1NaHCO3溶液中:c(Na+ )= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.常温下中和等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 |
| D.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,故新生成的 AgCl可转化为AgI |
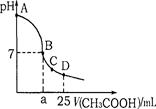
醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.醋酸溶液中:c(H+)>c(CH3COO-)>c(OH-) |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
| C.等体积、等物质的量浓度的醋酸与氢氧化钠溶液混合:c(Na+)=c(CH3COO-) |
| D.中和等体积、等物质的量浓度的CH3COOH溶液和HCl溶液所消耗的NaOH物质的量相等 |
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下,下列判断不正确的是
| 实验编号 | c(HA)/ mo1·L-l | c(NaOH)/ mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH =9 |
| 乙 | c1 | 0.2 | pH =7 |
A.cl一定等于0.2
B.HA的电离方程式是HA
 H++A-
H++A-C.乙反应后溶液中:c(Na+)=c(HA)+c(A一)
D.甲反应后溶液中:c(Na+)>c(A一)>c(OH一)>c(H+)
常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是
| A.反应过程中,CH3COOH的电离程度增大 |
| B.若a+b=14,则混合后pH=7 |
| C.若混合后pH=5.3,则c(Na+)< c( CH3COO-) |
| D.若混合后CH3COOH与NaOH恰好完全反应,则混合前a+b<14 |