题目内容
14.关于如图所示的原电池,下列说法错误的是( )
| A. | Cu为正极,Zn为负极 | B. | 该装置能将化学能转化为电能 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 正极反应为:2H++2e-═H2↑ |
分析 原电池中,活泼金属锌作负极,负极发生氧化反应,正极铜发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极,据此分析.
解答 解:A、该装置是原电池装置,Zn比Cu活泼,失去电子,作电池的负极,Cu作电池的正极,故A正确;
B、该装置是原电池装置,把化学能转化为电能,故B正确;
C、原电池中电子从负极流向正极,所以是从锌极流向铜极,故C错误;
D、正极是Cu极,氢离子放电生成氢气,反应为2H++2e-═H2↑,故D正确;
故选:C.
点评 本题考查原电池,利用氧化还原反应来分析电极反应是解答本题的关键,并熟悉工作原理来解答,难度不大.

练习册系列答案
相关题目
4.能正确表示下列反应的离子方程式是( )
| A. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | 氯化亚铁溶液中加入硝酸:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| C. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O |
5.下列各组P、Q原子中,彼此的化学性质一定相似的是( )
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
9.下列各组物质中,互为同位素的是( )
| A. | T2O与D2O | B. | 4019K与4020Ca | ||
| C. | O2和O3 | D. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C |
6.化学为人类基本的生存需要、进而追求生活乃至生命质量的提升提供了重要的保障.但某些人的贪得无厌和对化学原理的滥用败坏了化学学科声誉,我们每个人都应该避免成为这样的人.下列科学史上的重要发现与发明,从原理上看与化学学科没有直接相关性的是( )
| A. | 1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 | |
| B. | 1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 | |
| C. | 1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 | |
| D. | 1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
3.下列实验现象预测正确的是( )
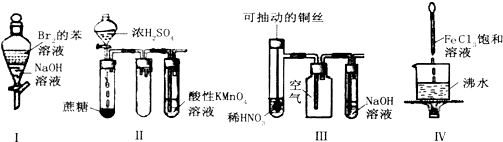

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
4.下列离子方程式书写正确的是( )
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| B. | 向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+Cl2+H2O=SO42-+2Cl-+2HSO3- | |
| C. | 电解KBr溶液时阴极的电极反应式为:K++e-=K | |
| D. | 将Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O |