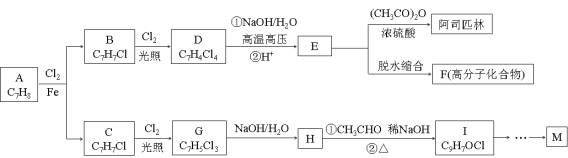
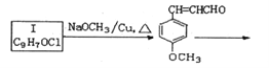
题目内容
【题目】已知:25℃时,某些弱酸的电离平衡常数如下表。下列说法正确的是

A. 向漂白粉溶液中加入少量NaHSO3可增强漂白性
B. Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2C032-+SO2+H2O=2HCO3-+S032-
C. 相同浓度的NaC1O、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:NaClO>Na2C03>NaHC03
D. 相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
【答案】B
【解析】A. 向漂白粉溶液中加入少量NaHSO3,亚硫酸氢钠被氧化,漂白性降低,A错误;B. 亚硫酸的酸性强于碳酸,则Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2C032-+SO2+H2O=2HCO3-+S032-,B正确;C. 酸性:H2CO3>HClO>HCO3-,相同浓度的NaC1O、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:Na2C03>NaClO>NaHC03,C错误;D. 次氯酸根离子的水解程度大于醋酸根,则相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),D错误,答案选B。

【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
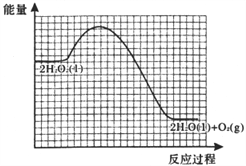
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______
(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。