题目内容
3.已知在常温下,醋酸、硼酸和碳酸的电离平衡常数分别为:K(CH3COOH)=1.75×10-5,K(H3BO3)=5.7×10-10,K1(H2CO3)=4.4×10-7、K2(H2CO3)=4.7×10-11.则下列的说法中正确的是( )| A. | 醋酸、碳酸和硼酸分别属于一元酸、二元酸和三元酸 | |
| B. | 等物质的量浓度的碳酸溶液和硼酸溶液的pH:碳酸>硼酸 | |
| C. | 在碳酸钠溶液和碳酸氢钠溶液中都存在如下离子浓度关系:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 等物质的量浓度的碳酸钠溶液和醋酸钠溶液的pH:碳酸钠>醋酸钠 |
分析 A、硼酸是一元酸;
B、碳酸的K1大于硼酸的K,碳酸的酸性强于硼酸;
C、据电荷守恒分析;
D、酸的酸性越弱,其酸根的水解程度越强.
解答 解:A、醋酸、碳酸和硼酸分别属于一元酸、二元酸和一元酸,故A错误;
B、碳酸的酸性比硼酸强,所以等物质的量浓度的碳酸溶液和硼酸溶液的pH:碳酸<硼酸,故B错误;
C、据电荷守恒,碳酸钠溶液和碳酸氢钠溶液中都存在如下离子浓度关系:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故C错误;
D、醋酸的酸性比碳酸强,所以碳酸根离子的水解程度大于醋酸根离子,其水解显碱性,所以等物质的量浓度的碳酸钠溶液和醋酸钠溶液的pH:碳酸钠>醋酸钠,故D正确;
故选D.
点评 本题考查了据弱酸的电离平衡常数判断弱酸的酸性强弱以及溶液中的电荷守恒、盐类水解等知识点,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
12.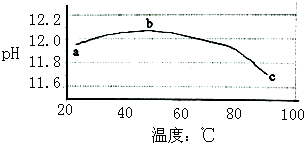 某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
 某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )| A. | 碳酸钠水解是吸热反应 | B. | ab段说明水解平衡向右移动 | ||
| C. | bc段说明水解平衡向左移动 | D. | 水的电离平衡也对pH产生影响 |
14.除去混在HNO3中的少量盐酸,可加适量的( )
| A. | NaOH | B. | BaCl2 | C. | Zn | D. | AgNO3 |
18.下列有关化学用语或叙述正确的是( )
| A. | C30、N70、C120、C340等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
8.电视剧《活色生香》向我们充分展示了“香”的魅力.低级酯类化合物是具有芳香气味的液体,下列说法中,利用了酯的某种化学性质的是( )
| A. | 用酒精可以提取某些花香中的酯类香精,制成香水 | |
| B. | 炒菜时加一些料酒和食醋,使菜更香 | |
| C. | 用热水洗涤碗筷去油腻比冷水效果好 | |
| D. | 各种水果有不同的香味,是因为含有不同的酯 |
15.下列说法正确的是( )
| A. | 乳酸薄荷醇酯(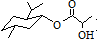 )只能发生水解、氧化、消去反应 )只能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛不是同系物,它们的氢化产物也一定不是同系物 | |
| C. | 分子式为C7H14O2的有机物中,含3个甲基且能发生银镜反应还能发生水解反应的同分异构体数目是8个 | |
| D. | 硝化甘油、硝化纤维、硬脂酸甘油酯两两互不为同分异构体,其水解产物也完全不相同 |
12.为了探索外界条件对反应aX(g)+bY(g)?cZ(g)+Q的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示.以下判断正确的是( )


| A. | Q<0,a+b>c | B. | Q<0,a+b<c | C. | Q>0,a+b>c | D. | Q>0,a+b<c |