题目内容
12.为了探索外界条件对反应aX(g)+bY(g)?cZ(g)+Q的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示.以下判断正确的是( )
| A. | Q<0,a+b>c | B. | Q<0,a+b<c | C. | Q>0,a+b>c | D. | Q>0,a+b<c |
分析 根据图象判断温度、压强的变化和Z的物质的量分数的变化趋势,再根据平衡移动原理中温度、压强对平衡移动的影响,可得出反应热以及反应前后化学计量数关系.
解答 解:由图象可知,降低温度,Z的物质的量分数增大,说明降低温度平衡向正反应方向移动,所以正反应是放热的,则Q>0,
降低压强,Z的物质的量分数减小,说明压强减小,平衡向着逆反应方向移动,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有a+b>c,
故选C.
点评 本题考查温度、压强等外界条件对平衡移动的影响,题目难度中等,解答本题的关键是能正确分析图象曲线的变化趋势.

练习册系列答案
相关题目
2.工业上可用亚氢酸钠和盐酸为原料制备ClO2,反应如下:
5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O(主反应)
NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O(副反应)
下列说法正确的是( )
5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O(主反应)
NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O(副反应)
下列说法正确的是( )
| A. | 主反应和副反应的还原剂都是HCl | |
| B. | 副反应中氧化剂和还原剂物质的量之比为1:4 | |
| C. | 盐酸的还原性与浓度有关,浓度越大还原性越强 | |
| D. | 为加快ClO2的生成速率,应选用较大浓度的盐酸 |
3.已知在常温下,醋酸、硼酸和碳酸的电离平衡常数分别为:K(CH3COOH)=1.75×10-5,K(H3BO3)=5.7×10-10,K1(H2CO3)=4.4×10-7、K2(H2CO3)=4.7×10-11.则下列的说法中正确的是( )
| A. | 醋酸、碳酸和硼酸分别属于一元酸、二元酸和三元酸 | |
| B. | 等物质的量浓度的碳酸溶液和硼酸溶液的pH:碳酸>硼酸 | |
| C. | 在碳酸钠溶液和碳酸氢钠溶液中都存在如下离子浓度关系:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 等物质的量浓度的碳酸钠溶液和醋酸钠溶液的pH:碳酸钠>醋酸钠 |
20.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则不可能的情形是( )
| A. | 由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 由0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合而成 | |
| C. | 由0.1 mol/LCH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| D. | 向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
7.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻(如图所示),则下列说法正确的是( )
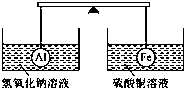

| A. | 两烧杯中均无气泡产生 | B. | 左边烧杯中的溶液质量减少了 | ||
| C. | 去掉两烧杯,杠杆仍平衡 | D. | 右边铁球上出现红色 |
4.下列说法正确的是( )
| A. | 蛋白质溶液、淀粉溶液都属胶体 | |
| B. | 碳纤维、纤维素都是有机高分子 | |
| C. | 花生油,牛油互为同分异构体 | |
| D. | 普通玻璃、石英玻璃、水玻璃都是硅酸盐 |
1.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解 | |
| C. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| D. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 |
2.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |