题目内容
【题目】短周期元素A、B、D、E、G、J在周期表中的位置如下:
A | |||||||
B | D | ||||||
E | G | J |
根据上表回答问题:
(1)![]() 在周期表中的位置是______,D的原子结构示意图_____。
在周期表中的位置是______,D的原子结构示意图_____。
(2)![]() 、B、E、G的原子半径由大到小的顺序是_____
、B、E、G的原子半径由大到小的顺序是_____![]() 填元素符号
填元素符号![]() 。
。
(3)![]() 、D的气态氢化物的稳定性关系为______
、D的气态氢化物的稳定性关系为______![]() 填化学式
填化学式![]() ,它们都属于______
,它们都属于______![]() 离子化合物或共价化合物
离子化合物或共价化合物![]() 。
。
(4)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式________________。
【答案】第3周期第VIIA族  Na>Al>N>H NH3<H2O 共价化合物 Al(OH)3+NaOH=NaAlO2+2H2O
Na>Al>N>H NH3<H2O 共价化合物 Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
由短周期元素A、B、D、E、G、J在周期表中的位置可知,A为H元素、B为N元素、D为O元素、E为Na元素、G为Al元素、J为Cl元素。
(1)J为Cl元素,位于元素周期表第三周期VIIA族,D为O元素,核电荷数为8,有两个电子层,最外层的电子数为6,原子结构示意图为 ;
;
(2)A为H元素、B为N元素、E为Na元素、G为Al元素,电子层数越大,主族元素的原子半径越大,同周期元素自左而右,原子半径依次减小,则原子半径由大到小的顺序是Na>Al>N>H;
(3)![]() 、D的气态氢化物分别为NH3、H2O,都是只含有共价键的共价化合物,同周期元素自左而右,元素非金属性依次增强,元素非金属性越强,简单氢化物的热稳定性越强,氧元素的非金属性强于氮元素,则N、O的气态氢化物的稳定性关系为NH3<H2O;
、D的气态氢化物分别为NH3、H2O,都是只含有共价键的共价化合物,同周期元素自左而右,元素非金属性依次增强,元素非金属性越强,简单氢化物的热稳定性越强,氧元素的非金属性强于氮元素,则N、O的气态氢化物的稳定性关系为NH3<H2O;
(4)氢氧化铝是两性氢氧化物,既能与强酸反应又能与强碱反应,氢氧化铝跟氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。

【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
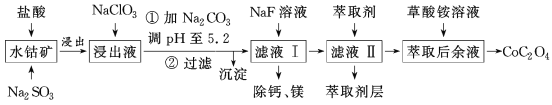
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
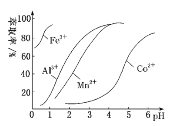
滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。