题目内容
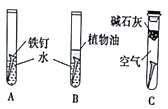
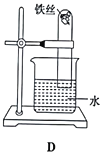
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。

试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为__________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)A中加入的试剂可能是______,作用是__________;B中加入的试剂可能是__________,作用是_______;E中加入的试剂可能是__________,作用是__________。
(4)可以证明气体X中含有氢气的实验现象:C中__________,D中__________。
【答案】Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O 当Zn与浓硫酸反应时,浓硫酸逐渐变稀,Zn与稀硫酸反应可产生H2 品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入装置D中 黑色粉末变成红色 白色粉末变成蓝色
ZnSO4+SO2↑+2H2O 当Zn与浓硫酸反应时,浓硫酸逐渐变稀,Zn与稀硫酸反应可产生H2 品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入装置D中 黑色粉末变成红色 白色粉末变成蓝色
【解析】
(1)二氧化硫由锌和浓硫酸反应得到;
(2)浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
(3)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,据此分析(3)(4)。
(1)二氧化硫由锌和浓硫酸反应得到,锌和浓硫酸反应得二氧化硫、硫酸锌和水,反应的化学方程式为:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O;
ZnSO4+SO2↑+2H2O;
(2)在Zn与浓H2SO4反应过程中,H2SO4被消耗且有水生成,H2SO4浓度逐渐减小,变成稀硫酸,Zn与稀H2SO4反应生成H2;
(3)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中 的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰;
(5)证明生成的气体中含有水蒸气的现象是:C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色。

 阅读快车系列答案
阅读快车系列答案【题目】以赤铁矿为原料,利用高炉炼铁的基本反应为:
i.Fe2O3(s)+3CO![]() 2Fe(s)+3CO2(g)△H1
2Fe(s)+3CO2(g)△H1
其中CO产生的反应是:
ii.C(焦炭,s)+O2(空气,g)=CO2(g)△H2<0
iii.C(焦炭,s)+CO2(g)=2CO(g)△H3>0
(1)以焦炭炼铁的反应:3C(焦炭,s)+2Fe2O3(s)![]() 4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
(2)反应i的平衡常数与温度的关系如下表,请回答:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64.0 | 50.6 | 42.9 |
①当反应温度为1150℃,高炉中n(CO):n(CO2)=4:1时,v正_____v逆(填大于、小于、或等于)。
②己知高炉容积VL,反应温度1000℃。若提供给i反应的CO共2.24×103L(已折算标准状况),该反应经过tmin达平衡,则CO2在此段时间的反应速率为________(用V、t代数式表示)。
(3)T℃下,初始体积均为2L,初始压强均为100kPa的甲(固定体积),乙(固定压强)两容器中各充入2molCO进行反应iii,达平衡时甲中气体压强变为原来的4/5倍。请回答:
①下列可以判断甲中反应达平衡的是________________(填字母序号)。
a.2c(CO2)=c(CO)
b.v正(CO2)=2v逆(CO)
c.气体密度不再改变
d.气体平均分子量不再改变
②下图为甲、乙两容器中CO的百分含量(CO%)与时间(t)的关系示意图,其中代表乙容器的是___________(填字母编号),理由是______________________。
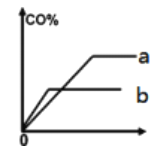
③乙容器中达平衡时的平衡常数Kp=___________________(Kp为用压强表达的平衡常数)。
【题目】某化学小组在实验室制取Na2O2。查阅资料可知,钠与空气在453~473 K之间可生成Na2O,迅速提高温度到573~673 K之间可生成Na2O2,若温度提高到733~873 K之间Na2O2可分解。除Li外其他碱金属不与N2反应。
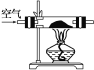
(1)甲组设计制取Na2O2装置如图。
①使用该装置制取的Na2O2中可能含有的杂质为________。
A.Na3N B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如下:
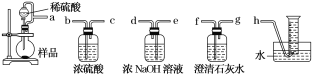
烧瓶中发生的主要反应的化学方程式是______________________。分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果________(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是________。
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果________(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是____(填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是____________________。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需要测定的有关数据_________________________________________________________________。