题目内容
【题目】以赤铁矿为原料,利用高炉炼铁的基本反应为:
i.Fe2O3(s)+3CO![]() 2Fe(s)+3CO2(g)△H1
2Fe(s)+3CO2(g)△H1
其中CO产生的反应是:
ii.C(焦炭,s)+O2(空气,g)=CO2(g)△H2<0
iii.C(焦炭,s)+CO2(g)=2CO(g)△H3>0
(1)以焦炭炼铁的反应:3C(焦炭,s)+2Fe2O3(s)![]() 4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
(2)反应i的平衡常数与温度的关系如下表,请回答:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64.0 | 50.6 | 42.9 |
①当反应温度为1150℃,高炉中n(CO):n(CO2)=4:1时,v正_____v逆(填大于、小于、或等于)。
②己知高炉容积VL,反应温度1000℃。若提供给i反应的CO共2.24×103L(已折算标准状况),该反应经过tmin达平衡,则CO2在此段时间的反应速率为________(用V、t代数式表示)。
(3)T℃下,初始体积均为2L,初始压强均为100kPa的甲(固定体积),乙(固定压强)两容器中各充入2molCO进行反应iii,达平衡时甲中气体压强变为原来的4/5倍。请回答:
①下列可以判断甲中反应达平衡的是________________(填字母序号)。
a.2c(CO2)=c(CO)
b.v正(CO2)=2v逆(CO)
c.气体密度不再改变
d.气体平均分子量不再改变
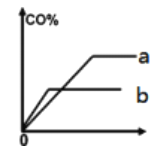
②下图为甲、乙两容器中CO的百分含量(CO%)与时间(t)的关系示意图,其中代表乙容器的是___________(填字母编号),理由是______________________。
③乙容器中达平衡时的平衡常数Kp=___________________(Kp为用压强表达的平衡常数)。
【答案】2△H1+3△H3 大于 ![]() mol/(L·min) cd b 乙容器相当于甲加压,加压使得反应速率加快,先达到平衡;同时加压使得平衡向着气体分于数减小的方向,即逆向移动,故CO含量乙<甲 180 kPa
mol/(L·min) cd b 乙容器相当于甲加压,加压使得反应速率加快,先达到平衡;同时加压使得平衡向着气体分于数减小的方向,即逆向移动,故CO含量乙<甲 180 kPa
【解析】
(1)根据盖斯定律计算;
(2)①利用浓度商与平衡常数大小进行判断;
②v(CO2)=△n/Vt;
(3)①根据平衡状态的特征判断,当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
②图中先出现拐点,对应的压强大。
③平衡三段式列式计算。
(1) i.Fe2O3(s)+3CO![]() 2Fe(s)+3CO2(g) △H1
2Fe(s)+3CO2(g) △H1
其中CO产生的反应是:
ii. C(焦炭,s)+O2(空气,g)=CO2(g)△H2<0
iii. C(焦炭,s)+CO2(g)=2CO(g) △H3>0
i×2+iii×3得:以焦炭炼铁的反应:3C(焦炭,s)+2Fe2O3(s)![]() 4Fe(s)+3CO2(g)的△H=2△H1+3△H3;
4Fe(s)+3CO2(g)的△H=2△H1+3△H3;
(2)①在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO![]() 2Fe(s)+3CO2(g),该反应的平衡常数表达式为:K=c3(CO2)/c3(CO)=50.6。当反应温度为1150℃,高炉中n(CO):n(CO2)=4:1时,Qc=c3(CO2)/c3(CO)=1/43<50.6,反应正向进行,故v正大于v逆 ;
2Fe(s)+3CO2(g),该反应的平衡常数表达式为:K=c3(CO2)/c3(CO)=50.6。当反应温度为1150℃,高炉中n(CO):n(CO2)=4:1时,Qc=c3(CO2)/c3(CO)=1/43<50.6,反应正向进行,故v正大于v逆 ;
②n(CO2)=![]() =100mol
=100mol
K=c3(CO2)/c3(CO)=64,c(CO2)=4c(CO),得平衡时n(CO2)=4[100mol-n(CO2)],得n(CO2)=80mol,v(CO2)=![]()
(3)iii. C(焦炭,s)+CO2(g)=2CO(g) △H3>0
①a.2c(CO2)=c(CO)没有指明正逆速率,故错误;
b.应为2v正(CO2)=v逆 (CO),故错误;
c.气体质量发生变化,容器体积不变,气体密度不再改变,说明反应达到平衡状态,故正确
d.反应前后气体物质的量改变,气体质量发生变化,混合气体的平均相对分子质量不再变化,说明反应达到平衡状态,故正确;
故选cd。
②下图为甲、乙两容器中CO的百分含量(CO%)与时间(t)的关系示意图,其中代表乙容器的是b,乙容器相当于甲加压,加压使得反应速率加快,先达到平衡;同时加压使得平衡向着气体分于数减小的方向,即逆向移动,故CO含量乙<甲。
③甲中C(焦炭,s)+CO2(g)=2CO(g)
起始量/mol 0 2
变化量/mol x/2 x
平衡量/mol x/2 2-x
2-x+ x/2=2×4/5
x=0.8
k=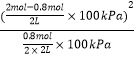 =180 kPa
=180 kPa

 同步练习强化拓展系列答案
同步练习强化拓展系列答案