题目内容
【题目】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)![]() 3Ca2+(aq)+2PO43﹣(aq)
3Ca2+(aq)+2PO43﹣(aq)
(1)溶度积Ksp=_________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1,c(PO43﹣)=1.58×10﹣6 molL﹣1,Ksp=___________.
【答案】c3(Ca2+)·c2(PO43﹣)2.0×10-29
【解析】
(1)根据溶解平衡方程式可知溶度积Ksp=c3(Ca2+)·c2(PO43﹣);
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1,c(PO43﹣)=1.58×10﹣6 molL﹣1,则Ksp=(2.0×10﹣6)3·(1.58×10﹣6)2≈2.0×10-29。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
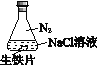
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2