题目内容
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A.a-3=c+2 | B.质子数a>b>c>d |
| C.离子的还原性Y2-<Z- | D.离子半径X+< W3+< Y2-< Z- |
A
试题分析:元素的原子失去电子变为阳离子;元素的原子获得电子变为阴离子。A.aW3+和cY2-具有相同的电子层结构,所以a-3=c+2。正确。B.质子数a>b >d>c。错误。C.对于电子层结构相同的离子来说,离子所带的电荷越多,离子的还原性就越强。所以离子的还原性Y2->Z-。错误。D.对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。所以离子半径W3+<X+< Y2-< Z-。错误。

练习册系列答案
相关题目
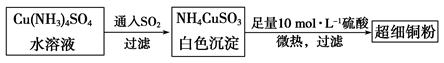
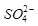 的空间构型为_____________,
的空间构型为_____________,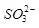 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。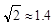 ,列式并计算结果)。
,列式并计算结果)。
 主族
主族