题目内容
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系,其关系如图所示。下列说法错误的是( )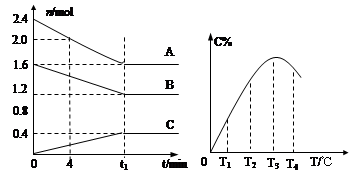
A.0~4分钟时,A的平均反应速率为 0.01mol·L-1·min-1
B.由T1向T2变化时,V正>V逆
C.此反应的正反应为吸热反应
D.其它条件不变,加压,达新平衡时,C的体积分数增大
C
解析试题分析:A.根据图示可知:V(A)=(2.4-2.0)mol÷10L÷4min=0.01mol/(L·min),错误;B.在由T1向T2变化时,反应未达到平衡,由于反应是从正反应方向开始的,所以V正>V逆,正确;C.反应在T3时达到平衡,由于升高温度,C的含量降低,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以此反应的正反应为放热反应,错误;D.根据图示可知;反应的方程式是:2A(g)+B(g) C(g)由于该反应的正反应是气体体积减小的反应,所以其它条件不变,加压,平衡正向移动,所以达新平衡时,C的体积分数增大,正确。
C(g)由于该反应的正反应是气体体积减小的反应,所以其它条件不变,加压,平衡正向移动,所以达新平衡时,C的体积分数增大,正确。
考点:考查化学反应速率的计算、外界条件对化学平衡移动的影响的知识。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案 mA(s)+nB(g)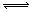 qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
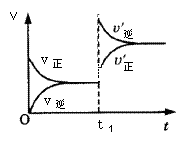
甲 乙
| A.n<q | B.n>q |
| C.正反应为放热反应 | D.X点比Y点反应速率快 |
25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表,下列说法错误的是
| 物 质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
B.反应可表示为X+3Y
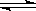 2Z,其平衡常数为1600
2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
对于反应 A + B 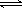 C,下列条件的改变一定能使化学反应加快的是
C,下列条件的改变一定能使化学反应加快的是
| A.升高体系的温度 | B.增加A的物质的量 |
| C.减少C的物质的量 | D.增大体系的压强 |
一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应:2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
| A.反应进行30 s时,正反应速率等于逆反应速率 |
| B.反应进行80 s时,逆反应速率大于正反应速率 |
| C.反应进行60 s时,X的物质的量浓度为0.04 mol/L |
| D.反应进行60 s时,Y的转化率为70% |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO +3HSO
+3HSO ===3SO
===3SO +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )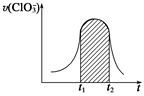
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
D.图中的阴影部分“面积”为t1~t2时间内ClO 的物质的量浓度的减小值 的物质的量浓度的减小值 |
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
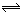 H2(气)+I2(气)已达平衡状态的是
H2(气)+I2(气)已达平衡状态的是 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是