题目内容
.(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
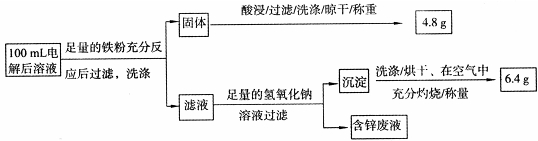
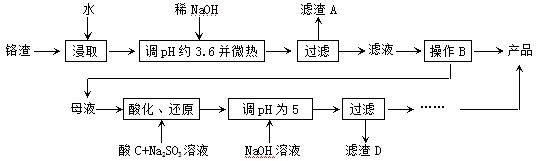
(1)某含铬废水处理的主要流程如下图所示:
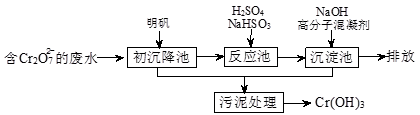
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
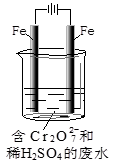
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
32.(16分)
(1)(8分)①Al3++3H2O Al(OH)3+3H+(2分,化学式、系数各1分)
Al(OH)3+3H+(2分,化学式、系数各1分)
② 1 Cr2O72-+ 3 HSO3-+ 5H+ = 2 Cr3++ 3 SO42-+ 4 H2O(2分。写出H+1分,系数全部正确1分)
③Cr3++ 3OH-=Cr(OH)3↓(2分,化学式、系数各1分) 取沉淀后的上层清液测定其pH(1分),若pH≥8,则沉淀完全(1分)
(2)(8分)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O(3分,化学式2分,系数1分) ②水中的H+在阴极区放电(1分),H+浓度减小促使水的电离平衡向右移动(1分),OH-浓度增大与金属阳离子在阴极区结合而沉淀完全(1分) ③0.08(2分。说明:含铬和铁两种氢氧化物沉淀)
解析试题分析: (1)①明矾是含有12个结晶水的KAl(SO4)2,该物质可做净水剂,此处加入该物质主要是利用其中的铝离子水解使溶液呈酸性,同时生成的氢氧化铝吸附杂质沉淀起到沉降杂质净化溶液的目的,所以此处考查的是铝离子的水解反应方程式,Al3++3H2O Al(OH)3+3H+ 。
Al(OH)3+3H+ 。
②此氧化还原反应中Cr2O72- 中铬的化合价+6→+3,HSO3- 中的S的化合价+4→+6,所以根据电子守恒配平发生化合价变化的的物质的,然后根据方程式前面少O的原则,前面所缺项应为H+,所以再根据电荷守恒配平方程式得1 Cr2O72-+ 3 HSO3-+ 5H+ = 2 Cr3++ 3 SO42-+ 4 H2O。
③题中流程可以看出,向沉淀池中加入氢氧化钠是为了沉淀得到Cr(OH)3 ,因此题干中所谓的沉淀法和中和法,主要是加入氢氧化钠能够首先中和溶液中的H+,其次能与溶液中的Cr3+结合生成Cr(OH)3 沉淀,因此此处发生的反应离子方程式除了H++OH-=H2O外,还有Cr3++ 3OH-=Cr(OH)3↓。若要证明Cr3+沉淀完全,则可以根据表中给的数据,Cr3+沉淀完全时的pH值等于8.0,若Cr3+沉淀完全,则用pH计可以测得溶液的pH值为8.0。
(2)①Fe2+ 具有还原性,酸性溶液中的Cr2O72- 强氧化性,二者容易发生氧化还原反应,因为此处是在处理酸性溶液中的Cr2O72- ,因此此出也是利用上题的沉淀法把Cr2O72-还原+3,价,然后沉淀除去,所以此反应的方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
②该电解反应的阳极铁电极主要发生氧化反应溶解产生亚铁离子还原Cr2O72- ,而阴极则主要是溶液中水电离的H+得到电子被还原,所以由于溶液中水电离的H+反应了,H+浓度减小水的电离平衡右移,OH-浓度增大,与金属阳离子Cr3+、Fe3+结合生成沉淀。
③根据①中反应的离子方程式可知,生成的金属阳离子比例关系是2Cr3+~6Fe3+ ,因此若含有0.01mol Cr2O72-,则会生成Cr3+ 0.02mol,Fe3+ 有0.06mol,因此总共会生成0.08mol的沉淀。
考点:本题考查的是简单的化学工艺流程。

 阅读快车系列答案
阅读快车系列答案把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为 ( )
| A.M + 3N mol | B.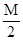 + 3N mol + 3N mol | C.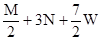 mol mol | D.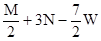 mol mol |
乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示 。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
| A.与CH3OH加成生成CH3CH2COOH | B.与H2O加成生成CH3COOH |
C.与CH3COOH加成生成CH3― ―O― ―O― ―CH3 ―CH3 | D.与HCl加成生成CH3COCl |
下列实验不能获得成功的是 ( )
| | 实验目的 | 实验步骤 |
| A. | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B. | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。


 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。