题目内容
6.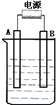 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:(1)A接的是电源的负极,B电极反应:4OH--4e-=2H2O+O2↑.
(2)写出电解时反应的总离子方程式2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑.
(3)电解后溶液的pH=1;要使电解后溶液恢复到电解前的状态,则需加入CuO或CuCO3,其质量为2g或3.1g.(假设电解前后溶液的体积不变)
分析 (1)和电源的负极相连的是电解池的阴极发生还原反应,和电源的正极相连的是电解池的阳极发生氧化反应;
(2)电解可溶性的铜盐的实质是电解盐和水,根据电极反应书写电解方程式;
(3)根据电解后所得溶液中氢离子的浓度计算溶液的pH,电解后溶液复原,遵循的原则是:出什么加什么,根据元素守恒来计算所加物质的质量.
解答 解:(1)电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,反应:4OH--4e-=2H2O+O2↑,故答案为:负;4OH--4e-=2H2O+O2↑;
(2)阴极反应:2Cu2++4e-→2Cu,阳极反应:4OH--4e-=2H2O+O2↑,电解时反应的总离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;
(3)取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以生成氢离子的物质的量为0.05mol,所以c(H+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,即pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3,所加氧化铜的质量=0.025mol×80g/mol=2g,加碳酸铜时则质量=0.025mol×124g/mol=3.1g,故答案为:1;CuO或CuCO3; 2g或3.1g.
点评 本题考查学生电解池的工作原理,可以根据所学知识进行回答,难度不大.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 聚氯乙烯是纯净物 | |
| B. | 合成聚氯乙烯的单体是CH2=CH-Cl | |
| C. | 聚氯乙烯的长链上含有碳碳双键 | |
| D. | 聚氯乙烯分子中的化学键在自然界中容易断裂 |
| A. | 2.8g | B. | 3.36g | C. | 4.2g | D. | 5.6g |
| A. | 硫酸铜溶液中加入氢氧化钡溶液Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 向碳酸氢钠溶液中加入盐酸溶液:HCO3-+H+═CO2↑+H2O | |
| D. | 用氨水和氯化铝反应制备氢氧化铝沉淀:Al3++3OH-═Al(OH)3↓ |
 ,有关它的下列叙述不正确的是( )
,有关它的下列叙述不正确的是( )| A. | 它完全燃烧时的产物是P2O5 | B. | 它不溶于水 | ||
| C. | 它在常温下呈固态 | D. | 它与白磷互为同分异构体 |
 Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题:
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题: 氨的合成是目前普遍使用的人工固氮方法.
氨的合成是目前普遍使用的人工固氮方法.