题目内容
11.下列反应的离子方程式书写正确的是( )| A. | 硫酸铜溶液中加入氢氧化钡溶液Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 向碳酸氢钠溶液中加入盐酸溶液:HCO3-+H+═CO2↑+H2O | |
| D. | 用氨水和氯化铝反应制备氢氧化铝沉淀:Al3++3OH-═Al(OH)3↓ |
分析 A.硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀;
B.离子方程式两边正电荷不相等;
C.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
D.一水合氨不能拆开,应该保留分子式.
解答 解:A.硫酸铜溶液中加入氢氧化钡溶液,反应的离子方程式为:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓,故A正确;
B.铜片插入硝酸银溶液中,反应生成硝酸铜和银,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故B错误;
C.向碳酸氢钠溶液中加入盐酸溶液,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故C正确;
D.氨水为弱碱,一水合氨必须保留分子式,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选AC.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
19.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠并探究氯水的性质.
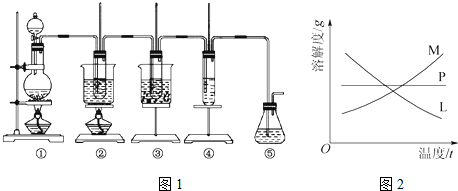
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
16.关于卤代烃的说法正确的是( )
| A. | 卤素原子是卤代烃的官能团.C-X之间的共用电子对偏向卤原子,形成一个极性较强的共价键,分子中C-X键易断裂 | |
| B. | 卤代烃难溶于水,易溶于大多数有机溶剂,常温下均呈液态,且密度均>1 g/cm3 | |
| C. | 强碱的水溶液中均可发生水解反应;在强碱的醇溶液中加热均可发生消去反应 | |
| D. | 卤素原子的检验步骤:①取少量卤代烃;②加入NaOH溶液;③加热煮沸;④冷却;⑤加入硝酸银溶液 |
3.下列不是由于胶体的性质而产生的现象的是( )
| A. | 石膏能使豆浆变成豆腐 | |
| B. | 明矾净水 | |
| C. | 花粉在水面上做布朗运动 | |
| D. | 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 |
1.决定化学反应速率快慢的主要因素是( )
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 反应物的性质 |
 (1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸.
(1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸.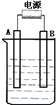 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: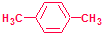 ,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.
,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.