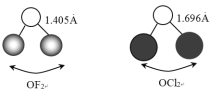
题目内容
【题目】将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1molL﹣1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
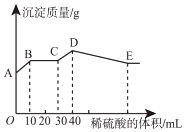
A.B点所表示的沉淀是:Al(OH)3、BaSO4
B.B﹣C段所发生反应的离子方程式是:H++OH﹣→H2O
C.A﹣B段发生反应的离子方程式:Ba2++SO42﹣→BaSO4↓
D.拐点E的横坐标为80mL
【答案】B
【解析】
根据图象可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子。
A.根据分析可知,B点沉淀为硫酸钡沉淀,故A错误;
B.BC段所发生反应的离子方程式为:H++OH﹣→H2O,故B正确;
C.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,故C错误;
D.CD段发生偏铝酸根离子与酸的反应,生成氢氧化铝沉淀消耗了10mL 1mol/L的稀硫酸,则稀硫酸的物质的量为:1mol/L×0.01L=0.01mol,消耗了0.02mol氢离子,根据反应AlO2﹣+H++H2O=Al(OH)3↓可知了生成0.02mol氢氧化铝沉淀;DE段氢氧化铝与氢离子反应,溶解0.02mol氢氧化铝需要消耗0.06mol氢离子,消耗硫酸的物质的量为0.03mol,消耗硫酸的体积为:![]() =0.03L=30mL,则拐点E的横坐标为:40mL+30mL=70mL,故D错误;
=0.03L=30mL,则拐点E的横坐标为:40mL+30mL=70mL,故D错误;
故选:B。

练习册系列答案
相关题目