题目内容
【题目】某Na2CO3和NaHCO3的混合溶液,取该溶液50.00mL加水稀释到1L。
(1)从稀释后溶液中取出20.00mL.测量溶液体积的仪器事先进行洗涤的洗涤液依次为:自来水、_____、_____,对溶液体积读数的方法是读出_____对应的刻度值。
(2)稀释后溶液用标准盐酸(0.2000mol/L)进行滴定:
①取20.00mL溶液(酚酞做指示剂)消耗标准盐酸12.00mL。
②取10.00mL(甲基橙做指示剂)消耗标准盐酸15.00mL。
判断①滴定终点的现象是_____。则此次测定原样品溶液中碳酸氢钠的浓度_____。
(3)重复上述(2)滴定操作1﹣2次的目的是_____。
【答案】蒸馏水 待测液 蓝线的粗细交界点 溶液从浅红色变为无色,且半分钟溶液颜色不恢复浅红色 1.2mol/L 减小滴定误差
【解析】
(1 )滴定实验中测量溶液体积的仪器一般用滴定管,可先洗涤,后润洗,分别用自来水、蒸馏水、待测液;对溶液体积读数的方法是:读出蓝线的粗细交界点对应的刻度值,
故答案为:蒸馏水;待测液;蓝线的粗细交界点;
(2)用标准盐酸(0.2000mol/L)进行滴定:
①上述所取20.00mL溶液(酚酞做指示剂)消耗标准盐酸12.00mL,发生反应为:Na2CO3+HCl=NaCl+NaHCO3,滴定终点现象为:溶液从浅红色变为无色,且半分钟溶液颜色不恢复浅红色;
②从1L稀释液中另取10.00mL(甲基橙做指示剂)消耗标准盐酸15.00mL,则20.00mL溶液消耗标准盐酸30.00mL,
发生反应:Na2CO3+2HCl=2NaCl+CO2+H2O、NaHCO3+HCl=NaCl+CO2+H2O,
设20mL溶液中含有xmolNa2CO3,ymolNaHCO3,
则:x=0.2mol/L×0.012L=0.0024mol,
2x+y=0.2mol/L×0.03L=0.006mol,
y=0.0012mol,
50.00mL原样品溶液中碳酸氢钠的浓度为: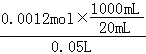 =1.2mol/L,
=1.2mol/L,
故答案为:溶液从浅红色变为无色,且半分钟溶液颜色不恢复浅红色;1.2mol/L;
(3)为了减小滴定误差,需要重复上述(2)滴定,
故答案为:减小滴定误差。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案