题目内容
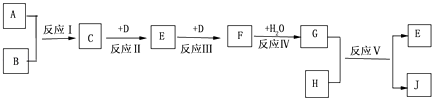
【题目】部分被氧化的Fe﹣Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如图处理:
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.该样品中Cu、O元素的质量比为10:1
C.V=448
D.溶解样品时消耗H2SO4的物质的量为0.04 mol
【答案】D
【解析】解:A.由于氧化性Fe3+>Cu2+>H+ , 铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+ , 故A错误;
B.由以上分析可知样品中含有3.2gCu元素,铁元素的物质的量为0.04mol,质量为0.04mol×56g/mol=2.24g,则氧元素的质量为5.92g﹣3.2g﹣2.24g=0.48g,则该样品中Cu、O元素的质量比为3.2:0.48,故B错误;
C.最后溶液中溶质为过量H2SO4和FeSO4 , 而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量 ![]() =0.03mol,它结合氢离子0.06mol,所以硫酸中有0.08﹣0.06=0.02molH+生成氢气,即生成0.01mol氢气,标况体积为224ml,故C错误;
=0.03mol,它结合氢离子0.06mol,所以硫酸中有0.08﹣0.06=0.02molH+生成氢气,即生成0.01mol氢气,标况体积为224ml,故C错误;
D.铁元素的物质的量为0.04mol,铁与过量稀硫酸反应生成硫酸亚铁,则反应消耗硫酸的物质的量为0.04mol,故D正确.
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目