题目内容
【题目】已知A、B、D、H是中学化学中常见的单质,J为蓝色溶液.转化关系如下(部分生成物及反应条件已略去):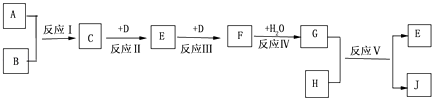
(1)若A、B均为气体时,当用玻璃棒分别蘸取C、G的浓溶液并使它们靠近时,有白烟生成,则:
①请写出下列物质的化学式D , E .
②请写出反应Ⅱ的化学方程式
(2)若A为气体,B为固体时,已知C在D中完全燃烧可生成E和水.E是一种常见的空气污染物,且将C与E混合可生成淡黄色固体B.写出C与E反应的化学方程式;简述检验气体E的方法 .
【答案】
(1)O2;NO;4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(2)2H2S+SO2=3S+2H2O;将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2
【解析】解:A、B、D、H是中学化学中常见的单质,J为蓝色溶液,应含有铜离子,根据各物质的转化关系,(1)若A、B均为气体时,当用玻璃棒分别蘸取C、G的浓溶液并使它们靠近时,有白烟生成,应为HCl或HNO3和NH3的反应生成NH4Cl,由于C连续与单质D反应后又与水反应生成G,则C为NH3 , D为O2 , E为NO,F为NO2 , G为HNO3 , A、B应为氮气和氢气,硝酸与铜反应生成硝酸铜和NO,所以H为Cu,J为Cu(NO3)2 , ①根据上面的分析可知,D为O2 , E为NO,
所以答案是:O2;NO;②反应Ⅱ的化学方程式为4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(2)若A为气体,B为固体时,已知C在D中完全燃烧可生成E和水,E是一种常见的空气污染物,且将C与E混合可生成淡黄色固体B,则A为H2 , B为S,C为H2S,D为O2 , E为SO2 , F为SO3 , G为H2SO4 , 硫与铜反应生成硫酸铜和SO2 , 所以H为Cu,J为CuSO4 , C与E反应的化学方程式为2H2S+SO2=3S+2H2O,检验气体SO2的方法是将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2 ,
4NO+6H2O;(2)若A为气体,B为固体时,已知C在D中完全燃烧可生成E和水,E是一种常见的空气污染物,且将C与E混合可生成淡黄色固体B,则A为H2 , B为S,C为H2S,D为O2 , E为SO2 , F为SO3 , G为H2SO4 , 硫与铜反应生成硫酸铜和SO2 , 所以H为Cu,J为CuSO4 , C与E反应的化学方程式为2H2S+SO2=3S+2H2O,检验气体SO2的方法是将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2 ,
所以答案是:2H2S+SO2=3S+2H2O;将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2 .