题目内容
根据表中信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
C
解析试题分析:A.对于同一主族的元素来说,元素的原子核外电子层数越多,元素形成的氢化物的稳定性就越差,所以氢化物的稳定性为H2T>H2R,错误;B.L、Q是同一主族的元素,由于元素的原子半径L>Q,所以单质与稀盐酸反应的剧烈程度为L>Q,错误;C.M与T形成的化合物是Al2O3是两性氧化物,具有两性,错误;D.L2+比R2-的核外电子数少8个。
考点:考查元素的原子结构与元素的化合物的性质的关系的知识。

练习册系列答案
相关题目
元素周期表中,划分周期的依据是
| A.元素的核电荷数 | B.元素原子的电子层数 |
| C.元素的化合价 | D.元素原子的最外层电子数 |
考古学常用14C来确定文物的历史年代,14C原子核内中子数是
| A.6 | B.8 | C.14 | D.20 |
下列叙述中正确的是 ( )
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.除短周期外,其它周期均有18种元素 |
| C.在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈 |
| D.在ⅠA族中,单质的熔、沸点随着原子半径的增大而逐渐升高 |
甲—辛等八种元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是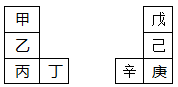
| A.乙的单质在空气中燃烧生成只含离子键的化合物 |
| B.原子半径:辛>己>戊 |
| C.丙与庚的原子核外电子数相差13 |
| D.最高价氧化物的水化物的碱性:丙>乙>甲 |
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.元素X的简单气态氢化物的热稳定性比W弱 |
| B.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C.化合物YX、ZX2、WX3中化学键类型相同 |
| D.原子半径的大小顺序:rY>rZ>rW>rX |
下列各组物质的性质及粒子的性质变化正确的是
| A.稳定性H2S>HCl>HBr>HI | B.酸性HF>HCl>HBr>HI |
| C.离子半径K+>Cl->S2->S | D.酸性HClO4>H2SO4>H2CO3>HClO |
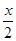 +18,N:2y+18 B.Z:
+18,N:2y+18 B.Z: