题目内容
9.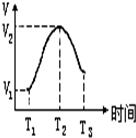 把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.
把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.
分析 金属锌与酸的反应为放热反应,从曲线的变化判断影响反应速率的因素.
解答 解:金属锌与酸的反应为放热反应,反应开始时,温度不断升高,则反应速率逐渐增大,但随着反应的进性,反应物的浓度逐渐降低,此时浓度的影响大于温度的影响,反应速率反而减小,
故答案为:锌与酸的反应是放热反应,溶液温度升高,反应速率加快;硫酸浓度减小,反应速率减慢.
点评 本题是考查化学反应速率图象的题目,题目难度不大,注意t2~t3速率变化的主要原因为易错点,把握影响反应速率的因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.化合物Y2X在水中能电离出具有相同电子层结构的阴阳离子,该化合物可能为( )
| A. | H2O | B. | Na2O | C. | KCl | D. | Na2S |
17.工业上获得有关物质的方法或途径正确的是( )
| A. | 将氯气通入澄清石灰水,获得漂白粉 | |
| B. | 将浓盐酸和二氧化锰加热反应制备氯气 | |
| C. | 将石油分馏,直接获得乙烯、丙烯及1,3-丁二烯 | |
| D. | 将煤进行干馏,获得焦炭、煤焦油等化工原料 |
4.在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是( )
| A. | 2Br-+4H++SO${\;}_{4}^{2-}$═SO2+Br2+2H2O | |
| B. | 2Fe3++SO2+2H2O═2Fe2++SO${\;}_{4}^{2-}$+4H+ | |
| C. | 2Fe2++Cl2═2Fe3++2Cl- | |
| D. | I2+SO2+2H2O═4H++SO${\;}_{4}^{2-}$+2I- |
14.A元素的阳离子与B元素的阴离子具有相同的电子层结构.有关两元素的叙述,正确的是( )
①原子半径A<B
②离子半径A>B
③原子序数A>B
④原子最外层电子数A<B
⑤A的最高正价与B的负价绝对值一定相等.
①原子半径A<B
②离子半径A>B
③原子序数A>B
④原子最外层电子数A<B
⑤A的最高正价与B的负价绝对值一定相等.
| A. | ①② | B. | ③④ | C. | ③⑤ | D. | ③④⑤ |
4.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是:( )
样品$→_{①△}^{足量硫酸}$溶液Ⅰ$→_{②}^{H_{2}O_{2}}$溶液Ⅱ$→_{调PH=5}^{③CuO}$浊液$→_{过滤}^{④}$滤液Ⅲ$→_{冷却结晶}^{蒸发浓缩}$ $→_{洗涤}^{过滤}$CuSO4•5H2O晶体.
样品$→_{①△}^{足量硫酸}$溶液Ⅰ$→_{②}^{H_{2}O_{2}}$溶液Ⅱ$→_{调PH=5}^{③CuO}$浊液$→_{过滤}^{④}$滤液Ⅲ$→_{冷却结晶}^{蒸发浓缩}$ $→_{洗涤}^{过滤}$CuSO4•5H2O晶体.
| A. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| B. | 利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 | |
| C. | 洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 | |
| D. | 若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
5.下列物质属于弱电解质的( )
| A. | 氨水 | B. | 水 | C. | 硫酸钡 | D. | 酒精 |
 、
、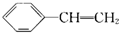 、
、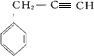 .
.