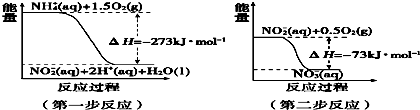
题目内容
13.Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe所属基本反应类型是置换反应.在该反应中Al元素的化合价升高,该元素的原子失电子,氧化剂是Fe2O3(填化学式).分析 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可.
解答 解:此反应为一种单质与一种化合物生成另外一种单质与另一种化合物的反应,属于置换反应类型,反应中Al元素的化合价升高,该元素的原子失电子,被氧化,得到氧化产物;而Fe元素的化合价降低,该元素的原子得电子,被还原,生成还原产物,该反应中,Fe2O3做氧化剂发生了还原反应,Al发生了氧化反应,
故答案为:置换反应,Al,失,Fe2O3.
点评 本题主要考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和反应类型的考查,题目难度不大.

练习册系列答案
相关题目
3.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②常温常压下,8gCH4含有的电子数为5NA
③0.5mol/L硫酸钠溶液中含有的Na+数为NA
④标准状况下,4.48L CCl4所含的原子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA.
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②常温常压下,8gCH4含有的电子数为5NA
③0.5mol/L硫酸钠溶液中含有的Na+数为NA
④标准状况下,4.48L CCl4所含的原子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA.
| A. | ①②③ | B. | ①②⑤ | C. | ②③⑤ | D. | ③④⑤ |
8.常温下,下列混合溶液中水的电离程度由大到小的顺序是( )
①pH=0的硫酸和水等体积混合后的溶液;②等体积等浓度的NaOH溶液和盐酸的混合液;③0.1mol•L-1的氨水和0.1mol•L-1的盐酸等体积混合后的溶液;④pH=3的盐酸和pH=12的NaOH溶液等体积混合后的溶液.
①pH=0的硫酸和水等体积混合后的溶液;②等体积等浓度的NaOH溶液和盐酸的混合液;③0.1mol•L-1的氨水和0.1mol•L-1的盐酸等体积混合后的溶液;④pH=3的盐酸和pH=12的NaOH溶液等体积混合后的溶液.
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ③>④>②>① | D. | ③>②>④>① |
10.下列第ⅦA族元素中,非金属性最强的是( )
| A. | 氟 | B. | 氯 | C. | 溴 | D. | 碘 |
 氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在
氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在