题目内容
下列反应或过程一定不是氧化还原反应的是( )
| A.ΔH<0 的反应 | B.古人用热分解法制水银 |
| C.用明矾净水 | D.实验室用浓盐酸和MnO2制Cl2 |
C
解析试题分析:氧化还原反应可以是放热反应;单质银可用热分解氧化银来制备,属于氧化还原反应;明矾净水用的是铝离子水解反应生成的氢氧化铝吸附作用净水,因此C中没有氧化还原反应发生;D中用浓盐酸制备氯气是氧化还原反应,故选C。
考点:本题考查的是氧化还原反应的特点。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于反应3Cl2+6NaOH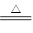 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
根据表中信息判断,下列选项正确的是( )
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1mol Cl2,转移电子5mol |
| D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2 |
下列事实不能说明元素的金属性或非金属性相对强弱的是
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
| D | t℃时,Br2 + H2 2HBr K = 5.6×107 2HBr K = 5.6×107I2 + H2  2HCl K = 43 2HCl K = 43 | 非金属性:Br > I |
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | | FeBr2 | / | | Cl- |
| ② | MnO2 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:MnO2>Fe3+>Cl2>Br2
C.表中②组反应的氧化产物是MnCl2,1molMnO2电子转移数目是2NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是
| A.a原子的最外层电子数比b原子的最外层电子数少 |
| B.把a、b两块金属片浸入稀硫酸中,用导线相连组成原电池时,电流由 a到b |
| C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多 |
| D.常温时,a能从水中置换出氢,而b不能 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是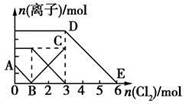
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2 |
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
| A.(a+3b) mol |
B.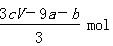 |
C.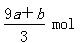 |
| D.(cV-3a-9b) mol |