题目内容
【题目】某化学兴趣小组的同学进行三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1中装有碱石灰。

(1)B中发生反应的化学方程式为______________________________________。
(2)C2的作用是_________________,C3中盛装的试剂是___________________。
(3)若实验中观察到E1、E4中的澄清石灰水均变浑浊,则E3中的现象是___________________,证明气体产物是___________________。
(4)实验装置中有2个酒精灯,先点燃A1,一段时间后,熄灭A1,关闭活塞a,再点燃A2,待D中的样品充分反应后,再次打开活塞a,点燃A1,则第二次点燃A1的理由是________________________________________________________。
(5)该小组同学查阅资料后推知, D中固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。实验测得C2、C3共增重5.4g;将D中固体生成物溶于水,测得最后残余固体的质量为6.88g。通过计算,固体产物中铁元素的存在形式为______(需表示出产物的物质的量)。
若要通过实验研究上述结论,除3%H2O2、蒸馏水外,还需要下列试剂中的___________。
A.1.0 mol·L-1HNO3 B.1.0 mol·L-1盐酸 C.1.0 mol·L-1NaOH溶液
D.0.1 mol·L-1KI溶液 E.0.1 mol·L-1CuSO4溶液 F.20%KSCN溶液。
【答案】NH4Cl+NaNO2 ==N2↑+NaCl+2H2O 检验水蒸气 P2O5或 CaCl2 溶液褪色(或变浅) CO2和 CO 第二次点燃 A1 ,是利用生成的氮气将装置中残余的气体吹到后续装置,使其充分吸收 0.02mol Fe、0.08mol FeO BEF
【解析】
根据题意可知,D装置中发生三草酸合铁酸钾的分解。利用B装置制取氮气作保护气。防止三草酸合铁酸钾的分解产物被氧化的同时,利用生成的氮气将装置中残余的气体吹到后续装置,使其充分吸收。通入D装置前,利用C1装置将挥发出的水蒸气吸收。将三草酸合铁酸钾的分解产物收依次通过C2、C3装置检验并吸收生成的水,依次通过E1、E2装置,检验并吸收产生的二氧化碳,通入E3、E4装置后,E4中澄清石灰水变浑浊,说明产物中含有具有还原性的气体,结合元素守恒可知,该气体为一氧化碳,据此分析;
(1)利用NH4Cl和饱和NaNO2混合液制N2,发生价态归中的氧化还原反应,生成氯化钠和水,其方程式为:NH4Cl+NaNO2 = N2↑+NaCl+2H2O;
(2)结合三草酸合铁酸钾晶体的化学式K3[Fe(C2O4)3]·3H2O可知,分解产物中含有水,故利用C2装置中的无水硫酸铜检验水蒸气;利用C3装置吸收水蒸气,故盛装的试剂是P2O5或 CaCl2;
(3)E1中的澄清石灰水均变浑浊,说明产生二氧化碳,并利用E2装置除去二氧化碳。依次通过E3和E4装置,若E4装置中澄清石灰水变浑浊,则说明气体与E3中高锰酸钾溶液发生了氧化还原反应,生成了二氧化碳,故推测该气体为CO。E3的现象是溶液褪色(或变浅),该过程证明气体产物是CO2和 CO;
(4)第二次点燃A1的理由是:利用生成的氮气将装置中残余的气体吹到后续装置,使其充分吸收;
(5)反应过程中生成水0.3mol,可知参与反应的三草酸合铁酸钾的物质的量为0.1mol,其中含铁元素0.1mol。由于产物中铁元素不能以+3价的形式存在,故生成物中可能存在0价铁单质或+2价的氧化亚铁。若为单质铁,溶于水后测得最后残余固体的质量为5.6g,不符合题意,若为氧化亚铁,则最后残余固体的质量为7.2g,故推测产物为铁和氧化亚铁的混合物。设生成单质铁x mol,氧化亚铁(0.1-x)mol,可得56x+72(0.1-x)=6.88,解得x=0.02mol,故固体产物中铁元素的存在形式为:0.02mol Fe、0.08mol FeO;
探究固体产物中铁元素的存在形式,可以将固体产物放入足量的CuSO4溶液中搅拌,使其充分反应,然后过滤洗涤沉淀,再加入盐酸。若溶液中有红色不溶物,则说明产物中含有铁,向溶液中加入KSCN溶液,不变红色,再加入双氧水,若变红色,则说明固体产物中含有FeO,故答案为BEF;

【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183kJ/mol
2NO(g) △H1=+183kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0mol/L | 3.0mol/L | 0 |
投料II | 0.5mol/L | 1.5mol/L | 1.0mol/L |
①按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X
的变化关系。
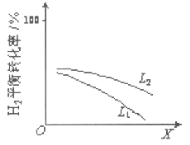
iX代表的物理量是_________,
ii判断L1、L2的大小关系,并简述理由:_____________。

