题目内容
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
【答案】D
【解析】A、甲组实验中等浓度、等体积的HA和NaOH混合,二者恰好反应生成NaA和水。如果混合溶液pH=7,则NaA是强酸强碱盐,HA是强酸;如果溶液pH>7,则NaA是强碱弱碱盐,HA是弱酸,故A正确;B、乙组实验中溶液混合pH=7, 如果NaA是强酸强碱盐,其水溶液呈中性,则HA与NaOH为等体积等浓度混合,此时c1等于0.2molL-1;如果NaA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量,此时c1>0.2molL-1,故B正确;C、丙组实验,HA的浓度是NaOH的两倍,等体积混合后所得溶液溶质为NaA和HA,物质的量之比为1∶1,此时溶液呈中性,说明A-的水解程度等于HA的电离程度,故HA是弱酸,溶液中离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C正确;D、丁组实验HA与NaOH等浓度等体积混合,反应后溶质为NaA,溶液pH=9,则NaA为强碱弱酸盐;c(H+)=10-9mol/L,c(OH)= 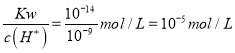 。根据质子守恒:c(H+)+ c(HA)= c(OH),所以c(OH-)-c(HA)= c(H+)=10-9mol/L,故D错误。故选D。
。根据质子守恒:c(H+)+ c(HA)= c(OH),所以c(OH-)-c(HA)= c(H+)=10-9mol/L,故D错误。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C.830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆
D.830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60%