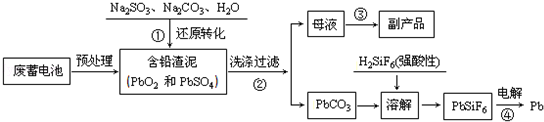
题目内容
20.有A、B、C、D四种强电解质,它们在水中电离可以产生下列离子(每种物质只含一种阴离子且互不重复)| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
C溶液与D溶液混合只产生沉淀,B溶液与C溶液混合只产生刺激性气味的气体,A溶液与D溶液混合时无明显现象.则
(1)A为CH3COONaB为NH4Cl(写化学式)
(2)若常温下浓度为Cmol/L的A溶液中水电离出的C(H+)=10-5mol/L,则此溶液的PH=9.在此条件下,若将浓度均为2cmol/L的A与B溶液等体积混合后,所得溶液中由水电离的C(H+)>10-5mol/L( 填“>”“<”或“=”)此溶液的PH近似等于7.
(3)25C0时0.1mol/LB溶液的PH=a,则B溶液中 C(H+)-C(NH3.H2O)=10 a-14mol/L(用a表示)
(4)25C0时,在一定体积的0.005mol/L的C溶液中.加入一定体积的0.00125mol/L的盐酸混合后PH=11,若不考虑溶液体积变化,则C溶液与盐酸溶液的体积比为1:4.
分析 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(1)上述分析可知A为醋酸钠、B是氯化铵;
(2)若常温下浓度为Cmol/L的A为醋酸钠溶液中水电离出的C(H+)=c(OH-)=10-5mol/L,醋酸根离子水解显碱性,依据溶液中离子积常数计算得到氢原子氢离子浓度,计算溶液PH,在此条件下,若将浓度均为2cmol/L的A为醋酸钠溶液与B为氯化铵溶液等体积混合后,铵根离子水解和醋酸根离子水解都促进水的电离,所得溶液中由水电离的氢离子浓度大于10-5mol/L,醋酸根离子水解程度和铵根离子水解程度近似相同,溶液呈中性;
(3)根据溶液中电荷守恒、物料守恒计算c(H+)-c(NH3•H2O);
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3 mol/L,根据C(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{混合溶液体积}$计算氢氧化钡和盐酸的体积之比.
解答 解:有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(1)通过以上分析知,A是醋酸钠、B是氯化铵化学式为:CH3COONa;NH4Cl,故答案为:CH3COONa;NH4Cl;
(2)若常温下浓度为Cmol/L的A为醋酸钠溶液中水电离出的C(H+)=c(OH-)=10-5mol/L,醋酸根离子水解显碱性,溶液中氢离子浓度=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,溶液PH=-lg[H+]=9,在此条件下,若将浓度均为2cmol/L的A为醋酸钠溶液与B为氯化铵溶液等体积混合后,铵根离子水解和醋酸根离子水解都促进水的电离,所得溶液中由水电离的氢离子浓度大于10-5mol/L,醋酸根离子水解程度和铵根离子水解程度近似相同,溶液呈中性,故答案为:9;>;7;
(3)根据溶液中电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据溶液中物料守恒得 c(NH3.H2O)+c(NH4+)=c(Cl-),将两个等式相减得c(H+)-c(NH3•H2O)=c(OH-)=10 a-14,故答案为:10 a-14mol/L;
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{混合溶液体积}$=$\frac{0.005×2×X-0.00125Y}{X+Y}$=10-3 mol/L,X:Y=1:4,故答案为:1:4.
点评 本题以化合物的推断为载体考查了物质的量的有关计算、离子浓度大小的比较等知识点,明确物质的性质是推断化合物的关键,本题的难点是判断溶液中离子浓度大小的比较,根据物料守恒和电荷守恒来判断即可,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.168升 | B. | 0.14升 | C. | 0.336升 | D. | 0.24升 |
| A. | 235U比239 Pu原子核内少4个中子 | |
| B. | 核反应堆中使用的重水与水互为同位素 | |
| C. | 石油、天然气等化石燃料属于可再生能源 | |
| D. | 合理使用核能可有效减少温室气体的排放 |
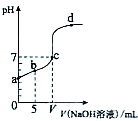 向10.00ml 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH溶液,溶液pH变化曲线如图所示.下列说法不正确的是( )
向10.00ml 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH溶液,溶液pH变化曲线如图所示.下列说法不正确的是( )| A. | HA是弱酸 | |
| B. | b点表示的溶液中:2c(Na+)═c(A-)+c(HA) | |
| C. | b、c、d点表示的溶液中:c(Na+)+c(H+)═c(A-)+c(OH-) | |
| D. | c点时:V=10.00 ml |
 ,物质A的化学式MgO.CaO.
,物质A的化学式MgO.CaO. .
.