题目内容
12.某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生0.025mol的气体时,CuSO4恰好被完全电解,得密度为1.2g/cm3的溶液100mL,完成下列各小题:(1)CuSO4溶液呈酸性的原因(用离子方程式表示):Cu2++2H2O?2H++Cu(OH)2;CuSO4溶液中下列离子浓度关系正确的D;
A.c(Cu2+)>c(SO42-)>c(H+)>c(OH-) B.c(Cu2+)+c(H+)═c(SO42-)+c(OH-)
C.c(SO42-)-c(OH-)═c(Cu2+)-c(H+) D.2c(Cu2+)+c(H+)═2c(SO42-)+c(OH-)
(2)电解后所得溶液的pH=0;电解前所取CuSO4溶液的质量为124.0克.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入的物质为(写化学式)CuO,质量为4.0克.
分析 (1)硫酸铜中铜离子水解导致溶液显示酸性,根据溶液中离子的水解结合电荷守恒确定离子浓度之间的大小关系;
(2)用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,当阳极产生0.025mol的气体时,电子转移0.025mol×4=0.1mol,同时阴极析出铜6.4g,据此计算溶液中c(H+)和溶液质量,并求pH;
(3)电解过程中依据出什么加什么原则,据此结合元素守恒分析计算.
解答 解:(1)硫酸铜中铜离子水解导致溶液显示酸性Cu2++2H2O?2H++Cu(OH)2,所以c(Cu2+)<c(SO42-),c(H+)>c(OH-),即c(SO42-)>c(Cu2+)>c(H+)>c(OH-),故A错误,根据电荷守恒:2c(Cu2+)+c(H+)═2c(SO42-)+c(OH-),故BC错误,选D.
故答案为:Cu2++2H2O?2H++Cu(OH)2;D;
(2)用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;阳极产生0.025mol的气体为氧气,电子转移0.025mol×4=0.1mol,同时阴极析出铜3.2g,电解过程中,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:
2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
2mol 4mol 1mol
n(Cu2+) n(H+) 0.025mol
n(H+)=$\frac{0.025×4}{1}$=0.1mol,c(H+)=$\frac{0.1mol}{0.1L}$=1mol/L,故pH=0,析出氧气的质量为:0.025mol×32g/mol=0.8g,析出铜的质量为3.2g,故原溶液质量为:0.8g+3.2g+1.2g•cm-3×100mL=124.0g,
故答案为:0;124.0;
(3)电解过程中依据出什么加什么原则,电解过程中析出铜和氧气,所以要使电解后溶液恢复到电解前的状态加入氧化铜可以恢复溶液浓度,析出氧气的质量为0.025mol×32g/mol=0.8g,析出铜的质量为3.2g,故加入氧化铜的质量为0.8g+3.2g=4.0g,故答案为:CuO;4.0.
点评 本题考查了电解原理的应用,电极反应的书写方法,电子守恒的计算应用,中等难度,清楚电极反应是解题的关键.

①FeCl2 ②H2SO4 ③NH4NO3 ④FeCl3.
| A. | 只有②③④ | B. | 只有②④ | C. | 只有①③④ | D. | 全部 |
| A. | 配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸 | |
| B. | 可在FeCl2溶液的上面加一层苯,以隔绝空气 | |
| C. | 向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内 | |
| D. | 产生Fe(OH)2沉淀后,不能震荡试管 |
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
C溶液与D溶液混合只产生沉淀,B溶液与C溶液混合只产生刺激性气味的气体,A溶液与D溶液混合时无明显现象.则
(1)A为CH3COONaB为NH4Cl(写化学式)
(2)若常温下浓度为Cmol/L的A溶液中水电离出的C(H+)=10-5mol/L,则此溶液的PH=9.在此条件下,若将浓度均为2cmol/L的A与B溶液等体积混合后,所得溶液中由水电离的C(H+)>10-5mol/L( 填“>”“<”或“=”)此溶液的PH近似等于7.
(3)25C0时0.1mol/LB溶液的PH=a,则B溶液中 C(H+)-C(NH3.H2O)=10 a-14mol/L(用a表示)
(4)25C0时,在一定体积的0.005mol/L的C溶液中.加入一定体积的0.00125mol/L的盐酸混合后PH=11,若不考虑溶液体积变化,则C溶液与盐酸溶液的体积比为1:4.
| A. | 标准状况下,22.4 L氦气和1 mol氟气所含原子数均为2NA | |
| B. | 1 mol H2O、1 mol NH3 和1mo l OH-所含电子数均为10NA | |
| C. | 1 mol Na2O2与CO2反应电子转移为2NA | |
| D. | 标准状况下22.4L的氯气和某些物质反应,电子转移一定为2NA |
| A. | 金属氧化物 过氧化钠 Na2O | B. | 酸 硫酸 H2SO4 | ||
| C. | 盐 苛性钠 NaOH | D. | 碱 纯碱 Na2CO3 |
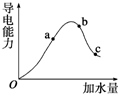 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.