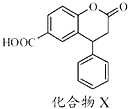
题目内容
【题目】天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣、HCO3﹣等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示: 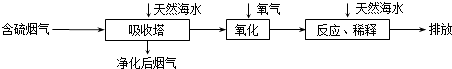 下列说法错误的是( )
下列说法错误的是( )
A.天然海水pH≈8的原因是由于海水中的CO32﹣、HCO3﹣水解
B.“氧化”是利用氧气将H2SO3、HSO3﹣、SO32﹣等氧化生成SO42﹣
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42﹣的物质的量浓度与进入吸收塔的天然海水相同
【答案】D
【解析】解:A.海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣、HCO﹣3等离子,在这些离子中能发生水解的是CO32﹣、HCO﹣3离子,CO32﹣+H2OHCO3﹣+OH﹣ , HCO3﹣+H2OH2CO3+OH﹣它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确; B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3﹣、SO32﹣等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4 , 故B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C正确;
D.从框图可知:排放”出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42﹣的物质的量浓度排放出来的海水中浓度小,故D错误;
故选D.

练习册系列答案
相关题目