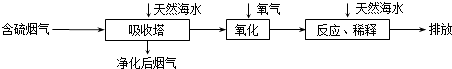
题目内容
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( ) 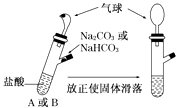
A.A装置的气球膨胀速率大
B.若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L
C.若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L
D.最终两试管中Na+、Cl﹣的物质的量一定相同
【答案】C
【解析】解:1.06g Na2CO3和0.84g NaHCO3的物质的量都是0.01nol. A、碳酸钠和酸反应分步进行,先生成碳酸氢钠,后碳酸氢钠和酸反应生成二氧化碳,所以A装置的气球膨胀速率小,故A错误;
B、碳酸钠和酸反应的离子方程式为:CO32﹣+H+=HCO3﹣、HCO3﹣+H+=CO2 ↑+H2O,碳酸氢钠和酸反应的离子方程式为HCO3﹣+H+=CO2 ↑+H2O;若最终两气球体积不同,所需酸的物质的量范围是:0<酸的物质的量<0.02mol,所以其浓度大于0小于2mol/L,故B错误;
C、1.06g Na2CO3和0.84g NaHCO3的物质的量相同,若最终两气球体积相同,说明酸的物质的量大于或等于0.02mol,所以其浓度大于或等于2mol/L,故C正确;
D、1.06g Na2CO3和0.84g NaHCO3的物质的量相同,所以Na2CO3和 NaHCO3中钠离子的物质的量不同,故最终两试管中Na+的物质的量一定不相同,故D错误;
故选C.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目