题目内容
对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+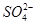 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 |
| B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为: N2(g)+3H2(g)  2NH3(g)△H="—38.6" kJ·mol—1 2NH3(g)△H="—38.6" kJ·mol—1 |
| C.标准状况:H2(g)+F2(g) ==="2HF(g)" △H=-270kJ/mol, |
| D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g)△H=-1025 kJ/mol |
D
硫酸钡存在溶解平衡,溶解是吸热的,选项A不正确;选项B不正确,因为反应是可逆反应,所以不能确定转化率,无法计算反应热,选项B不正确;热化学方程式一般是在常温常压下,所以选项C不正确,因此正确的答案选D。

练习册系列答案
相关题目
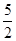 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1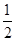 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1