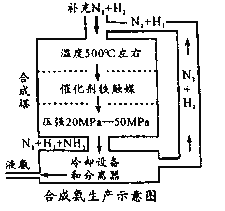
题目内容
【题目】下表为元素周期表的一部分,请参照①⑥在表中的位置,用化学用语回答下列问题。
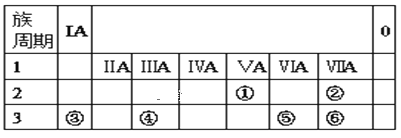
(1)元素①的原子结构示意图为__。
(2)元素②、③、⑥原子的半径大小(从大到小排列)___。
(3)元素⑤、⑥形成的气态氢化物稳定性___。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为___。
【答案】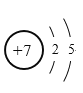 Na>Cl>F HCl>H2S Al(OH)3+OH-=AlO2-+2H2O
Na>Cl>F HCl>H2S Al(OH)3+OH-=AlO2-+2H2O
【解析】
根据周期表中的位置各元素分别为:①N②F③Na④Al⑤S⑥Cl
(1)元素①为N,N的原子结构示意图为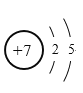 。故答案为:
。故答案为: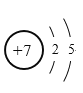 ;
;
(2)同一周期从左到右,原子半径由大变小,Na>Cl,同一主族,从上到下半径变大,Cl>F,元素②、③、⑥原子的半径大小(从大到小排列)Na>Cl>F。故答案为:Na>Cl>F;
(3)S、Cl在同一周期,从左到右元素的非金属性变大,氢化物的稳定性增强,元素⑤、⑥形成的气态氢化物稳定性HCl>H2S。故答案为:HCl>H2S;
(4)元素④的最高价氧化物的水化物Al(OH)3与元素③的最高价氧化物的水化物NaOH稀溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。故答案为:Al(OH)3+OH-=AlO2-+2H2O。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目