题目内容
【题目】(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
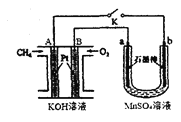
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
【答案】(1)负(1分)13O2+52e-26O2-(2分)
2C4H10+26O2--52e-8CO2+10H2O(2分)
(2)负(1分),CH4+10OH--8e-===CO![]() +7H2O(2分)正极(1分)
+7H2O(2分)正极(1分)
MnSO4+H2O=MnO2+H2+H2SO4(条件通电)(2分)减小(1分)
(3)正(1分)Cu2++2e=Cu(2分)
【解析】
试题解析:丁烷的燃料电池属于原电池,丁烷做负极;发生氧化反应:C4H10+34OH--26e-===4CO![]() +22H2O;氧气在正极发生还原反应,13O2+52e- 26O2-;固体电解质中的O2-向负极移动;(2)原电池:通入甲烷为负极,发生氧化反应:CH4+10OH--8e-===CO
+22H2O;氧气在正极发生还原反应,13O2+52e- 26O2-;固体电解质中的O2-向负极移动;(2)原电池:通入甲烷为负极,发生氧化反应:CH4+10OH--8e-===CO![]() +7H2O;电解池,a 为阳极;发生氧化反应:电解Mn2+--2e-+ 2H2O = MnO2+4H+;电解MnSO4溶液制MnO2的化学方程MnSO4+H2O=MnO2+H2+H2SO4 反应产生了硫酸,氢离子浓度增大,酸性增强,pH将变小;(3)精炼铜时,粗铜应与直流电源的正极相连,发生氧化反应,纯铜作阴极,发生还原反应:Cu2++ 2e = Cu;
+7H2O;电解池,a 为阳极;发生氧化反应:电解Mn2+--2e-+ 2H2O = MnO2+4H+;电解MnSO4溶液制MnO2的化学方程MnSO4+H2O=MnO2+H2+H2SO4 反应产生了硫酸,氢离子浓度增大,酸性增强,pH将变小;(3)精炼铜时,粗铜应与直流电源的正极相连,发生氧化反应,纯铜作阴极,发生还原反应:Cu2++ 2e = Cu;
考点:燃料电池、电解池相关知识考察。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案