题目内容
【题目】有氧化镁、氧化铝的混合物完全溶于200 mL盐酸,而后逐滴加入1.0 mol·L-1的NaOH溶液。溶液中生成沉淀的物质的量随加入的NaOH的溶液体积的变化,如图所示。
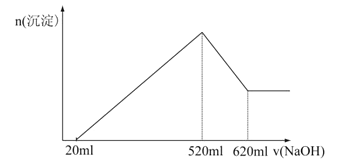
(1)试说明最初加入的20 mL NaOH溶液的作用。
(2)求所用盐酸的物质的量浓度。
(3)求氧化镁、氧化铝物质的量之比。
【答案】(1)中和过量的盐酸 (2)2.6mol·L-1 (3)2:1
【解析】
试题分析:(1)最初加入的20 mL NaOH溶液的作用是中和过量的盐酸。
(2)沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等,n(OH-)=1.0 mol·L-1 × 0.52 L = 0.52 mol,所以n(H-)也为0.52mol,盐酸的浓度为2.6mol·L-1 。
(3)根据Al(OH)3+OH-=AlO2-+2H2O
该反应用去的n(NaOH)=1.0mol·L-1×(0.62-0.52)L=0.10mol,
所以Al(OH)3为0.10mol,而Al2O3为0.050mol,根据Al3++3OH-=Al(OH)3,生成Al(OH)3用去0.30mol NaOH。而生成氢氧化镁用去0.20mol NaOH,氢氧化镁为0.10mol,则氧化镁、氧化铝物质的量比为2:1。

练习册系列答案
相关题目