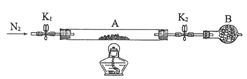
题目内容
【题目】钨是熔点最高的金属,也是重要的战略物资。自然界中钨矿石主要有黑钨矿和白钨矿两种。其中,黑钨矿主要成分是铁和锰的钨酸盐(FeWO4、MnWO4) 以及少量杂质(含Si、P、As元素的化合物)。由黑钨矿冶炼钨的“黑钨精矿高压碱煮(烧破)一溶剂萃取一蒸发结晶法”工艺流程如下图:
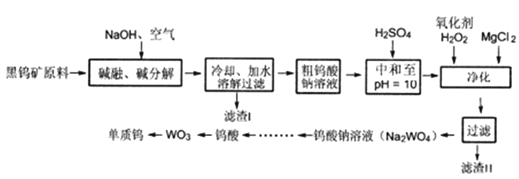
回答下列问题:
(1) 高压碱煮法中,“高压”的目的是_____________。
(2) 滤渣1的主要成分中含有的金属元素为_______。
(3) 除最后 一步外,流程中钨元素价态均未发生改变,则FeWO4中铁元素的价态为_____。第一步黑钨矿原料熔融时,FeWO4发生反应的化学方程式为________。
(4) H2SO4中和后溶液中还有SiO32-、AsO33-、AsO43-、PO43-等离子,则加入H2O2时发生反 应的离子方程式为_________。
(5) 钨酸钠溶液还含有NaOH、NaCl 和_____杂质。为了得到纯净的钨酸,需要经过萃取和反萃取工业流程。该操作中使用到的玻璃仪器有_________。 向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,此时钨元素处于_____层中(填“有机”或“无机”)。然后加入氨水反萃取、结晶得到仲钨酸铵(NH4)6W7O2·7H2O,仲钨酸铵加热分解得到三氧化钨的化学方程式为_________________________。
【答案】 增大氧气的浓度,提高反应速率 Fe、 Mn。 +2 4FeWO4+8NaOH+O2![]() 4Na2WO4+2Fe2O3+4H2O(无加热符号不扣分) AsO33-+H2O2=AsO43-+H2O Na2SO4 分液漏斗、烧杯 有机 (NH4)6W7O24·7H2O
4Na2WO4+2Fe2O3+4H2O(无加热符号不扣分) AsO33-+H2O2=AsO43-+H2O Na2SO4 分液漏斗、烧杯 有机 (NH4)6W7O24·7H2O![]() 6NH3↑+ 7WO3 + 10H2O
6NH3↑+ 7WO3 + 10H2O
【解析】试题分析:(1)氧气是反应物,增大压强可以提高反应速率;(2)黑钨矿主要成分是铁和锰的钨酸盐,高压碱煮,过滤后的溶液中含有钨酸钠,不含Fe、 Mn元素;(3) 钨酸钠中W元素的化合价是+6,根据化合价代数和等于0计算FeWO4中Fe元素的化合价; FeWO4与NaOH、O2加热熔融生成Na2WO4、Fe2O3;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-;(5)根据流程图,钨酸钠溶液中含有硫酸根离子;萃取分液用到的玻璃仪器是分液漏斗、烧杯;向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成NH3、WO3 、H2O;
解析:(1)高压碱煮法中,氧气是反应物,“高压”的目的是增大氧气的浓度,提高反应速率;(2)黑钨矿主要成分是铁和锰的钨酸盐,高压碱煮,过滤后的溶液是钨酸钠,不含Fe、 Mn元素,所以滤渣1的主要成分中含有的金属元素为Fe、 Mn;(3) 钨酸钠中W元素的化合价是+6,根据化合价代数和等于0,FeWO4中Fe元素的化合价为+2;FeWO4与NaOH、O2加热熔融生成Na2WO4、Fe2O3,反应方程式是4FeWO4+8NaOH+O2![]() 4Na2WO4+2Fe2O3+4H2O;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-,反应的话离子方程式是AsO33-+H2O2=AsO43-+H2O;(5)根据流程图,钨酸钠溶液中含有硫酸根离子,所以钨酸钠溶液还含有NaOH、NaCl和Na2SO4杂质;萃取分液用到的玻璃仪器是分液漏斗、烧杯;根据题意,向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成WO3 的方程式是(NH4)6W7O24·7H2O
4Na2WO4+2Fe2O3+4H2O;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-,反应的话离子方程式是AsO33-+H2O2=AsO43-+H2O;(5)根据流程图,钨酸钠溶液中含有硫酸根离子,所以钨酸钠溶液还含有NaOH、NaCl和Na2SO4杂质;萃取分液用到的玻璃仪器是分液漏斗、烧杯;根据题意,向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成WO3 的方程式是(NH4)6W7O24·7H2O![]() 6NH3↑+ 7WO3 + 10H2O;
6NH3↑+ 7WO3 + 10H2O;

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
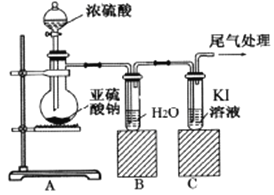
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。