题目内容
【题目】(1) CO2与NH3反应可合成化肥尿素。已知:
①2NH3(g)+CO2(g) = NH2CO2NH4(s) ΔH= -159.5kJmol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+H2O(g) ΔH= +116.5kJmol-1
③H2O(l) = H2O(g) ΔH= +44.0kJmol-1
写出CO2与NH3合成尿素[CO(NH2)2]和液态水的热化学反应方程式_____
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应逆反应的热化学方程式:______ 。
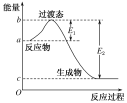
(3)下图是1mol NO2(g)与1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。
(4)已知H—H键、N≡N键、N-H键的键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/(kJ·mol-1) | 436 | 946 | 391 |
则反应N2(g)+3H2(g)=2NH3(g)的 ΔH=________。
【答案】2NH3(g)+CO2(g) =CO(NH2)2(s)+H2O(l) ΔH= -87.0kJmol-1 4HCl(g)+CO2(g) = 2Cl(g)+2H2O(g)+C(s) ΔH= +290kJmol-1 减小 不变 -92kJmol-1
【解析】
(1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H= -87.0kJmol-1;
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) △H= -290kJmol-1;
(3)催化剂能降低反应的活化能,在反应体系中加入催化剂E1减小;焓变与化学方程式的系数有关,在反应体系中加入催化剂ΔH不变;
(4)N2(g)+3H2(g)=2NH3(g) ΔH= -92kJmol-1,根据反应热的定义可知ΔH=反应物的键能之和-生成物的键能之和,即ΔH=(946+3×436-6×391)kJ/mol= -92kJmol-1。