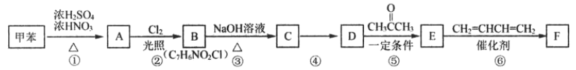
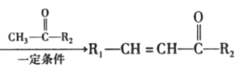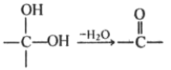��Ŀ����
����Ŀ����������茶���[(NH4)2Fe(SO4)2��6H2O]������ˮ���ڶ��������г����������������ӵı���Һ��ij��ѧ����С��ͬѧ��Ʋ��������ʵ�顣
I.(NH4)2Fe(SO4)2��6H2O����ȡ
ʵ�鲽�裺
�ٳ�ȡ4.2g����м����ƿ�У�����10mL30%��NaOH��Һ��������У���ʱ�䡣��ȥ��Һ��ˮϴ�����ԡ�
������������м�м���25mL3mol/LH2SO4��ˮԡ��������Ӧ��ȫ�����ȹ��ˡ�
������Һ�м��룭������ı���(NH4)2SO4��Һ������Ũ������ȴ�����ˣ�ϴ�ӣ�����ò�Ʒ��
��1��������м���NaOH��Һ��Ŀ����___��
��2������ڳ��ȹ��˵�Ŀ����___��
��3������ۼ���Ũ����Һʱ����Ҫ�������оƾ��ơ�___��___���̶����г��������⣩��
��.(NH4)2Fe(SO4)2��6H2O��FeSO4��7H2O�ȶ��ԵĶԱ��о�
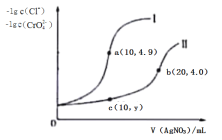
��ͼ����2֧��ͬ��ע�����зֱ�װ������ʵ��������־��壬����2֧ע��������ʹ���������ȣ�����ͷ���������ע���������������ã����ϳ�ʱ���ȡ�����־��壬�ֱ�μ�2��0.01mol/LKSCN��Һ������������ʵ�������¼���£�
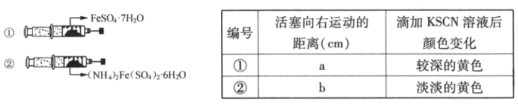
��4���ж�a___b������>������<������=���������ִ˽����ԭ�������___��
��5���жϴ�������(NH4)2Fe(SO4)2��6H2O���ȶ���___����������������С������FeSO4��7H2O��
��.����(NH4)2Fe(SO4)2��Һ���궨Ũ��
����(NH4)2Fe(SO4)2��Һ100mL��ȷ��ȡ20.00mL��������ƿ�У���10mLH2SO4���ڶ�����ָʾ��3��4�Σ���cmol/LK2Cr2O7��Һ�ζ�����Һ����غ�ɫ������K2Cr2O7��Һ�����ΪVmL��
��6������(NH4)2Fe(SO4)2��Һ��Ũ��Ϊ___ mol/L��
��7�����в�����ʹ������ҺŨ��ƫ�����___�����ţ���
A.��ƿ�ô�����Һ��ϴ
B.�ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ���������ʧ
C.�ζ������о���ҡ����ƿ����Һ����
D.�ζ�ǰƽ�Ӷ������ζ����Ӷ���
���𰸡���ȥ����м��������� ��ֹ����ʱFeSO4����������ģ�Ӱ����� ������ ������ > FeSO4��7H2O�����˽϶��O2�����������С���࣬���������ƶ������ ���� 0.3cV AB
��������
ͨ����м��ϡ���ᷴӦ�����������������������뱥��(NH4)2SO4��Һ��Ӧ��FeSO4+(NH4)2SO4= (NH4)2Fe(SO4)2����������Ũ������ȴ�����ˣ�ϴ�ӣ������.(NH4)2Fe(SO4)2��6H2O�����������ױ����������������ӣ���������KSCN��Һ����Һ��Ϊ��ɫ��(NH4)2Fe(SO4)2��K2Cr2O7��Һ����������ԭ��Ӧ��6Fe2++Cr2O72-+14H+= 6Fe3++2Cr3++7H2O��
(1)��м���溬�����ۣ�����NaOH��Һ��������У���ʱ���ȥ����м��������ۡ�
(2)��м��ϡ���ᷴӦ��������������Ϊ�˷�ֹ����ʱFeSO4����������ģ�Ӱ����ʣ�����Ҫ���ȹ��ˡ�
(3)����Ũ��������Ҫ���������м��Ƚ��У����в��������Ͻ��裬����Ҫ�������оƾ��ơ�������������
(4)������KSCN��Һ��Ӧ�����ɫ�жϣ������������ӱ������ij̶ȴ��ڢڣ���FeSO4��7H2O�����˽϶��O2�����������С���࣬���������ƶ��������a>b��
(5) (NH4)2Fe(SO4)2��6H2O���������ӱ������ij̶�С��FeSO4��7H2O���������ӱ������ij̶ȣ��ʴ�������(NH4)2Fe(SO4)2��6H2O���ȶ��Դ���FeSO4��7H2O��
(6) ����6Fe2++Cr2O72-+14H+= 6Fe3++2Cr3++7H2O��֪��n(Fe2+)=6n(Cr2O72-)����(NH4)2Fe(SO4)2��Һ��Ũ��![]() ��
��
(7) A.��ƿ�ô�����Һ��ϴ������ʹ�õı�Һ�����ƫ��ʹ������ҺŨ��ƫ��
B.�ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ���������ʧ�����±�Һ�������ƫ��ʹ������ҺŨ��ƫ��
C.�ζ������о���ҡ����ƿ����Һ��������������Һ�����ƫС����ʹ�õı�Һ�����С��ʹ������ҺŨ��ƫС��
D.�ζ�ǰƽ�Ӷ������ζ����Ӷ��������±�Һ�������ƫ�£�ʹ������ҺŨ��ƫС��
��ѡAB��