题目内容
【题目】SO2属于严重大气污染物,不能直接排放在空气中,其两种处理方法如下:

已知:①25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5。
②相关物质的Ksp数据如下表所示。

请回答下列问题:
(1)方法1工艺中利用了SO2的______________(填化学性质)。用过氧化氢也能氧化NH4HSO3溶液为铵盐溶液,过氧化氢电子式为__________________,将所得铵盐溶液变为无水铵盐的方法为__________。
(2)方法2生产工艺的优点有________________________________________。
(3)方法2中为检验分离器的分离效果,取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,若观察到___________________,证明分离效果较好。
(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36 mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是____________mol·L-1。
(5)氨水是一种重要的弱电解质,常温下,向0.1 mol/L氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH4+)=5 :9,此时溶液的pH=_______________。
【答案】 酸性 ![]() 将溶液进行蒸发浓缩、冷却结晶、干燥 溴可以循环利用,并获得清洁能源氢气 无淡黄色沉淀产生,最终生成白色沉淀
将溶液进行蒸发浓缩、冷却结晶、干燥 溴可以循环利用,并获得清洁能源氢气 无淡黄色沉淀产生,最终生成白色沉淀
10-3mol·L-1 9
【解析】(1)方法1工艺中利用了SO2的酸性,能与碱反应生成盐和水;过氧化氢电子式为![]() ,铵盐为固体溶质,将所得铵盐溶液变为无水铵盐的方法为:将溶液进行蒸发浓缩、冷却结晶、干燥;(2)方法2生产工艺的优点有:溴可以循环利用,并获得清洁能源氢气;(3)取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,检验Br―,若观察到无淡黄色沉淀产生,最终生成白色沉淀;(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36 mol·L-1,加入等体积的溴化钠溶液,Ksp=c(Ag+)c(Br-)=5.0×10-13,Ksp=c(Ag+)c(Cl-)=1.8×10-10 ,AgCl+Br-=AgBr+Cl-,
,铵盐为固体溶质,将所得铵盐溶液变为无水铵盐的方法为:将溶液进行蒸发浓缩、冷却结晶、干燥;(2)方法2生产工艺的优点有:溴可以循环利用,并获得清洁能源氢气;(3)取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,检验Br―,若观察到无淡黄色沉淀产生,最终生成白色沉淀;(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36 mol·L-1,加入等体积的溴化钠溶液,Ksp=c(Ag+)c(Br-)=5.0×10-13,Ksp=c(Ag+)c(Cl-)=1.8×10-10 ,AgCl+Br-=AgBr+Cl-, ,c(Br-)=
,c(Br-)=![]() =10-3mol·L-1,(5)向0.1 mol/L氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH4+)=5 :9,溶液中溶质为硝酸铵和一水合氨,NH3·H2O
=10-3mol·L-1,(5)向0.1 mol/L氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH4+)=5 :9,溶液中溶质为硝酸铵和一水合氨,NH3·H2O![]() NH4++OH-,25℃时.NH3·H2O的电离平衡常数Kb=1.8×10-5=
NH4++OH-,25℃时.NH3·H2O的电离平衡常数Kb=1.8×10-5=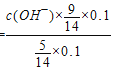 ,c(OH-)=10-5mol·L-1,c(H+)=10-9mol·L-1,PH=9。
,c(OH-)=10-5mol·L-1,c(H+)=10-9mol·L-1,PH=9。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案