题目内容
18.下列各组离子因发生氧化还原反应而不能大量共存的是( )| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、NO3-、SO42-、AlO2- | ||
| C. | OH-、HCO3-、Cl-、K+ | D. | Fe3+、K+、SCN-、Cl- |
分析 A.硝酸根离子在酸性条件下能够氧化亚铁离子;
B.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,但不属于氧化还原反应;
C.碳酸氢根离子与氢氧根离子反应,但不属于氧化还原反应;
D.铁离子与硫氰根离子反应生成硫氰化铁,不属于氧化还原反应.
解答 解:A.H+、Fe2+、NO3-之间发生氧化还原反应,在溶液中不能大量共存,故A正确;
B.Al3+、AlO2-之间发生双水解反应生成氢氧化铝沉淀,该反应不属于氧化还原反应,故B错误;
C.OH-、HCO3-之间发生中和反应生成碳酸根离子和水,不属于氧化还原反应,故C错误;
D.Fe3+、SCN-之间反应生成络合物硫氰化铁,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
8.下列反应的离子方程式,不正确的是( )
| A. | 氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 氧化铜和稀硫酸反应:CuO+2H+═Cu2++H2O | |
| C. | 碳酸氢钠溶液和稀硫酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
13.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 稀硫酸 | B. | Cu(NO3)2 溶液 | C. | 汽油、水混合物 | D. | Fe(OH)3胶体 |
3.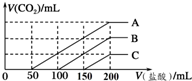 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 通入CO2后,A烧杯中的溶质成分是Na2CO3 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 原NaOH溶液的浓度为0.2 mol/L | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:2 |
10.下列物质中,不能发生水解反应的是( )
| A. | 果糖 | B. | 淀粉 | C. | 纤维素 | D. | 蛋白质 |
7.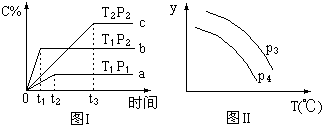 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3>P4,y轴表示A的物质的量 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均相对分子质量 |
8.部分短周期元素的性质或原子结构如下表所示:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期第ⅥA族.
②用电子式表示A和B元素组成的化合物的形成过程 .
.
(2)元素D与元素A相比,D的非金属性较强,下列表述能证明这一事实的是ad(填选项符号).
a.D的氢化物比A的氢化物稳定
b.常温下D的单质和A的单质状态不同
c.一定条件下D和A的单质都能与钠反应
d.D的最价氧化物对应的水化物酸性强于A的最价氧化物对应的水化物的酸性
(3)X是由A、B、C、D四种元素中的某种元素形成的单质,能经如图所示的过程转化为W(其他条件略去).
X$\stackrel{{O}_{2}}{→}$Y$\stackrel{{O}_{2}}{→}$Z$\stackrel{{H}_{2}O}{→}$W
①若Z是红棕色气体,则 Z $\stackrel{H_{2}O}{→}$ W 的化学方程式为3NO2+H2O=2HNO3+NO,此反应中氧化剂与还原剂的物质的量之比是1:2.
②若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,再滴加适量H2O2 溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族.
②用电子式表示A和B元素组成的化合物的形成过程
 .
.(2)元素D与元素A相比,D的非金属性较强,下列表述能证明这一事实的是ad(填选项符号).
a.D的氢化物比A的氢化物稳定
b.常温下D的单质和A的单质状态不同
c.一定条件下D和A的单质都能与钠反应
d.D的最价氧化物对应的水化物酸性强于A的最价氧化物对应的水化物的酸性
(3)X是由A、B、C、D四种元素中的某种元素形成的单质,能经如图所示的过程转化为W(其他条件略去).
X$\stackrel{{O}_{2}}{→}$Y$\stackrel{{O}_{2}}{→}$Z$\stackrel{{H}_{2}O}{→}$W
①若Z是红棕色气体,则 Z $\stackrel{H_{2}O}{→}$ W 的化学方程式为3NO2+H2O=2HNO3+NO,此反应中氧化剂与还原剂的物质的量之比是1:2.
②若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,再滴加适量H2O2 溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.