题目内容
【题目】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:
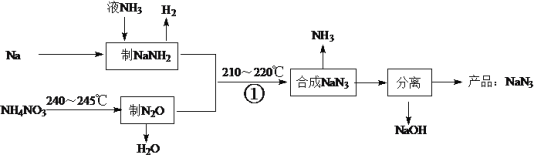
(1)钠元素在周期表中的位置是______________。
(2)NaN3中含有的化学键类型为_________________________________。
(3)NaNH2中氮元素的化合价为__________________。
(4)反应NH4NO3![]() N2O↑+2H2O↑中,每生成0.25molN2O转移电子数约_____个。
N2O↑+2H2O↑中,每生成0.25molN2O转移电子数约_____个。
(5)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为_______(N3-被氧化为N2)。
【答案】第三周期ⅠA族 离子键、共价键 —3 6.02×1023 ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
【解析】
根据元素的原子序数分析判断元素在周期表的位置;根据形成化合物的元素性质分析成键类型;根据反应中元素化合价的变化及电子转移守恒原理计算转移电子数;根据题干信息及氧化还原反应书写并配平氧化还原反应。
(1)Na的原子序数为11,位于周期表中第三周期ⅠA族,故答案为:第三周期,ⅠA族;
(2)根据题干信息知:NaN3=Na++N3-,则NaN3属于离子化合物,Na+与N3-通过离子键结合,而N3-中N原子通过共价键结合,所以NaN3含有的化学键类型为离子键、共价键,故答案为:离子键、共价键;
(3)NaNH2中,Na、H的化合价都为+1,结合化合物中元素的正、负化合价的代数和为0可知,氮元素的化合价为3价,故答案为:-3;
(4)NH4NO3中铵根离子中N化合价为-3价,硝酸根中N化合价为+5价,N2O中N化合价为+1,则根据氧化还原反应原理得,1mol-3价N失去4mol电子,电子转移给+5价N,最后都形成+1价N,即转移4mol电子时,生成1molN2O,则生成0.25molN2O转移电子1mol,约为6.02×1023,故答案为:6.02×1023;
(5)销毁NaN3可用NaClO溶液,NaN3中3价N被氧化成0价的氮气,次氯酸根离子中+1价Cl被还原为氯离子,结合电子守恒配平该反应的离子方程式为:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑,故答案为:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑。

【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。