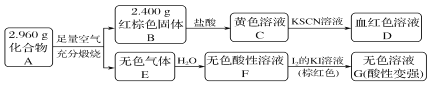
题目内容
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
【答案】C
【解析】
A.某铁的氧化物(FexO)1.52g溶于足量盐酸中,再通入氯气,将Fe2+完全氧化生成Fe3+,所以FexO溶于HCl有FeCl2生成,故A错误;
B.标准状况下,氯气的物质的量是0.112L÷22.4L/mol=0.005mol,故B错误;
C.FexO中Fe的平均化合价为+2/x,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等。标准状况下112mLCl2转移电子数为0.005mol×2=0.01mol。则有:1.52g/(56x+16)g·mol-1×(3-2/x)×x=0.01mol,解得x=0.8,故C正确;
D.通入Cl2后,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故D错误。
故答案选C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
②对于该反应,改变某一反应条件(温度T1>T2),下列图像正确的是_______(填序号)。

③某实验小组模拟上述净化过程,一定温度下,在 2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。
甲 | 乙 |
0.2mol NO2 | 0.1mol NO2 |
0.4mol CO | 0.2mol CO |
(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | a |

①375℃时,测得排出的气体中含0.45mol O2和0.0525mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是______________________。