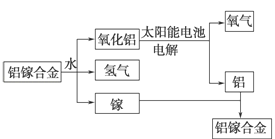
题目内容
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
【答案】B
【解析】A项,NH3中H原子、BF3中B原子不满足8电子的稳定结构;B项,在元素周期表中金属和非金属交界处可找到半导体材料;C项,由非金属元素组成的化合物不一定是共价化合物,如NH4Cl等铵盐;D项,第IA族的H元素与第VIIA族元素的原子间形成共价键。
A项,NH3中H原子最外层有2个电子、BF3中B原子最外层有6个电子,NH3中H原子、BF3中B原子不满足8电子的稳定结构,A项错误;B项,在元素周期表中金属和非金属交界处可找到半导体材料,B项正确;C项,由非金属元素组成的化合物不一定是共价化合物,如NH4Cl等铵盐,C项错误;D项,第IA族的H元素与第VIIA族元素的原子间形成共价键,D项错误;答案选B。

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
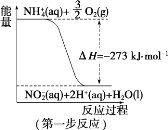

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。