题目内容
19.下列热化学方程式或离子方程式中,正确的是( )| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为 N2(g)+3H2(g) $\frac{\underline{\;\;\;\;\;\;\;催化剂\;\;\;\;\;\;\;}}{500℃、30MPa}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2Al${O}_{2}^{-}$+H2O |
分析 A.燃烧热概念是1mol可燃物完全燃烧生成稳定的氧化物放出的热量分析书写热化学方程式;
B.工业合成氨为可逆反应,不能进行到底;
C.一水合氨为弱电解质,不能拆;
D.二者反应生成偏铝酸钠和水.
解答 解:A.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1,中水的状态为气体,不是稳定氧化物,所以该热化学方程式不能表示燃烧热的热化学方程式,故A错误;
B.工业合成氨为可逆反应,不能进行到底,所以500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g)的物质的量小于1mol,放热小于19.3 kJ,故B错误;
C.氯化镁溶液与氨水反应,离子方程式:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C错误;
D.氧化铝溶于NaOH溶液,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式、化学方程式、热化学方程式的书写,明确燃烧热的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
9.120mL含有2mol碳酸钠的溶液和200mL,1.5mol•L-1盐酸,不管将前者滴加入后者,还是将后者滴加入前者,下列叙述正确的是( )
| A. | Na2CO3溶液中加盐酸,无气体生成 | |
| B. | 盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 | |
| C. | 无论怎么滴加,都有气体生成,且生成的气体一样多 | |
| D. | 无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多 |
7.设NA表示阿伏德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24LCH4含有的H原子数为0.1NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.2 NA |
4.下列实验结论正确的是( )
| A. | 向某溶液中滴加KSCN溶液不变色,滴加氯水后溶液显红色,原溶液中一定含Fe2+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液一定含有SO42- | |
| D. | 向某盐溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐 |
11.把温度为20℃,浓度为1.0mol•L-1的H2SO4和2.2mol•L-1的碱溶液各50mL混合(溶液密度均为1g•mL-1,比热容为4.184kJ•K-1•kg-1)轻轻搅动,测得酸碱混合液的温度变化数据如下:
则反应NH3•H2O?NH${\;}_{4}^{+}$+OH-的焓变约为(单位:kJ•mol-1)( )
| 反应物 | 起始温度t1℃ | 终止温度t2℃ |
| H2SO4+NaOH | 20 | 33.6 |
| H2SO4+NH3•H2O | 20 | 32.6 |
| A. | 2.1 | B. | 4.2 | ||
| C. | 52.7 | D. | 缺少数据无法计算 |
8.某有机物的结构简式如图此有机物的说法不正确的是( )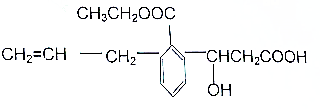

| A. | 可发生的反应类型有:取代、加成、消去、酯化、水解、氧化、中和、聚合 | |
| B. | 1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为2mol | |
| C. | 1mol该物质与Na、Na2CO3、NaHCO3反应时,所消耗的物质的量之比为2:1:2,产生的气体在标准状况下的体积比是2:1:2 | |
| D. | 该有机物属于芳香族化合物 |