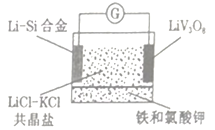
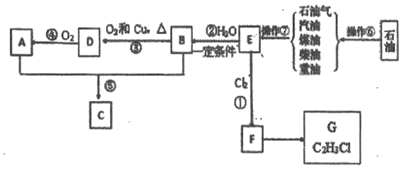
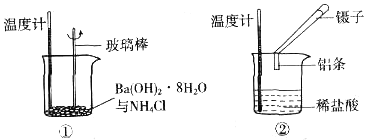
��Ŀ����
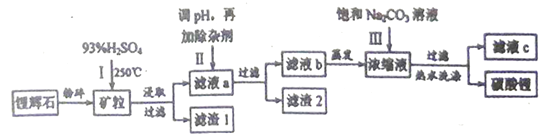
����Ŀ������ܶ���С�Ļ��ý������䵥�ʼ��仯��������LiAlH4��Li2CO3�� LiPF6���й㷺����;����ҵ����﮻�ʯ����Ҫ�ɷ�ΪLiAlSi2O6������������ơ�����þ�����������Ϊԭ�ϣ��Ʊ�Li2CO3�ĵĹ�������������
��֪��LiAlSi2O6��H2SO4������SiO2
��
Fe3+ | A13+ | Fe2+ | Mg2+ | |
����������ȫ����pH | 3.2 | 4.7 | 9.0 | 11.1 |
��ijЩ���ʵ��ܽ��(S) ���±�
t/�� | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
��ش�����������
��1��LiAlSi2O6��д�����������ʽ��___________________��
��֪����40��Li2CO3�ܽ��(������Һ���ܶ�Ϊag/cm3)����Li2CO3���ܶȻ�(Ksp) Ϊ________��(�ú���a�Ĵ���ʽ��ʾ)
��2������������Һa�м���ij��Ӽ�����Ϊ������H2O2��Һ��ʯ�����Na2CO3��Һ������������ԭ��Ӧ������ ����ʽΪ____________________��
��3����֪����2 ����Ҫ�ɷ���Mg(OH)2 ������Һa�м���ʯ�����������(���û�ѧƽ��ԭ������)___________________������ˮϴ��Li2CO3����Ŀ����___________________��
��.﮵����Ʊ����仯���������
1����̼��﮺����ᷴӦ�õ��Ȼ����Һ��д����δ��Ȼ����Һ�õ���ˮ�Ȼ�﮹����ʵ�鷽��__________________��
��2�� ��֪2Li+H2![]() 2LiH��LiH�����ܶ�Ϊ0 8g/cm3���������22.4L (��״��) H2�� ���ɵ�LiH����� ������ �� H2 ��� �� Ϊ________________��
2LiH��LiH�����ܶ�Ϊ0 8g/cm3���������22.4L (��״��) H2�� ���ɵ�LiH����� ������ �� H2 ��� �� Ϊ________________��
���𰸡� Li2O��Al2O3��4SiO2 Ksp=1.53a3��10-2 2Fe2++H2O2+2H+=2Fe3++2H2O ����ʯ������Һ�д����� ��Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) Mg2+��OH-����Mg(OH)2������OH-Ũ�ȼ�Сʹ��ƽ�������ƶ� ����̼��﮵���ʧ���������� ���ȱ�ͨ��HCl���壬ֱ�����ɼ�����ˮ�Ȼ�� 1/1120
Ca2+(aq)+2OH-(aq) Mg2+��OH-����Mg(OH)2������OH-Ũ�ȼ�Сʹ��ƽ�������ƶ� ����̼��﮵���ʧ���������� ���ȱ�ͨ��HCl���壬ֱ�����ɼ�����ˮ�Ȼ�� 1/1120
�������������������������Ϣ�����̿�֪��﮻�ʯ�����������ȡ��ȥ���ܵĶ������裬����Һ�м���ʯ�����Na2CO3��Һ������Һ��pH����˫��ˮ����������������ȥ���������ӣ��ٹ��ˣ�����Һ�м��뱥��̼������Һ������ӳ��������롢�ᴿ�õ�̼��ﮡ�
��1��LiAlSi2O6��д�����������ʽ��Li2O��Al2O3��4SiO2��
�ɱ���֪��40��Li2CO3�ܽ��(������Һ���ܶ�Ϊag/cm3)Ϊ1.17g����n(Li2CO3)=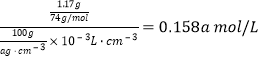 �����ԣ�Li2CO3���ܶȻ�(Ksp)ΪKsp=
�����ԣ�Li2CO3���ܶȻ�(Ksp)ΪKsp=![]() 1.58a3��10-2��
1.58a3��10-2��
��2�����������Һa�м���ij��Ӽ�����Ϊ������H2O2��Һ��ʯ�����Na2CO3��Һ������������ԭ��Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
��3����֪����2����Ҫ�ɷ���Mg(OH)2������Һa�м���ʯ�����������������ʯ��������Һ�д��ڳ����ܽ�ƽ�⣺��Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ����Һa��Mg2+��OH-����Mg(OH)2������OH-Ũ�ȼ�Сʹ��ƽ�������ƶ����������Ա�֤��Һ��OH-Ũ�ȱ����ڽϸ�ˮƽ��������Mg2+��ȫ�������ɱ����ܽ����Ϣ��֪��̼��﮵��ܽ�����¶����߶���С����������ˮϴ��Li2CO3����Ŀ���Ǽ���̼��﮵���ʧ������������
Ca2+(aq)+2OH-(aq) ����Һa��Mg2+��OH-����Mg(OH)2������OH-Ũ�ȼ�Сʹ��ƽ�������ƶ����������Ա�֤��Һ��OH-Ũ�ȱ����ڽϸ�ˮƽ��������Mg2+��ȫ�������ɱ����ܽ����Ϣ��֪��̼��﮵��ܽ�����¶����߶���С����������ˮϴ��Li2CO3����Ŀ���Ǽ���̼��﮵���ʧ������������
��.﮵����Ʊ����仯���������
��1����̼��﮺����ᷴӦ�õ��Ȼ����Һ���Ʊ���ˮ�Ȼ��ʱҪע���ֹ��ˮ�⣬�ʴ��Ȼ����Һ�õ���ˮ�Ȼ�﮹����ʵ�鷽���ǣ����ȱ�ͨ��HCl���壬ֱ�����ɼ�����ˮ�Ȼ����
��2����2Li+H2![]() 2LiH��֪���������22.4L(��״��)H2��������1mol H2����������2mol LiH��2mol LiH������Ϊ18g����֪LiH�����ܶ�Ϊ08g/cm3�������������������H2�����Ϊ
2LiH��֪���������22.4L(��״��)H2��������1mol H2����������2mol LiH��2mol LiH������Ϊ18g����֪LiH�����ܶ�Ϊ08g/cm3�������������������H2�����Ϊ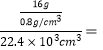 1/1120��
1/1120��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������¶��£�������������ĺ����ܱ������У���Ӧ2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)��ƽ�⣬����˵����ȷ����( )
C2H5OH(g)+3H2O(g)��ƽ�⣬����˵����ȷ����( )
���� | �¶�/K | ���ʵ���ʼŨ��(mol/L) | ���ʵ�ƽ��Ũ��(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
�� | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
�� | 500 | 0.40 | 1.20 | 0 | 0 | |
�� | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A.�÷�Ӧ����ӦΪ���ȷ�Ӧ
B.��ƽ��ʱ���ס��������ڣ�2c(CO2 �� ��)<c(CO2 �� ��)
C.��ƽ��ʱ���������е��淴Ӧ���ʱ��������еĴ�
D.��ƽ��ʱ��ת���ʣ�a(CO2 �� ��)+a(C2H5OH����)>1
����Ŀ����һ���¶��£�2 L�ܱ������ڣ���Ӧ2NO(g)+O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
ʱ�䣯min | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO))��mol | 0��020 | 0��010 | 0��008 | 0��007 | 0��007 | 0��007 |
�÷�Ӧ�ﵽƽ��״̬��ʱ����
A.3 min
B.1 min
C.2 min
D.0 min