题目内容
【题目】二氧化氯(ClO2)是一种黄绿色气体,极易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式为_________。
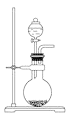
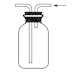
(2)某小组通过NaClO3法制备ClO2,其实验装置如下图。
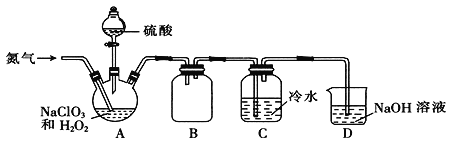
①通入氮气的主要作用有两个,一是可以起到搅拌作用,二是______________;
②装置B的作用是______________;
③装置A用于生成ClO2气体,该反应的化学方程式为______________;
④当看到装置C中导管液面上升时应进行的操作是______________。
(3)测定装置C中ClO2溶液的浓度:用______________(填仪器名称)取10.00 mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,用0.1000 mol·L-1的Na2S2O3标准液滴定至溶液呈淡黄色,发生反应:I2+2S2O32-=2I-+S4O62-,再加入__________作指示剂,继续滴定,当溶液_______,即为终点。平行滴定3次,标准液的平均用量为20.00 mL,则C中ClO2溶液的浓度为________mol·L-1。
【答案】2ClO2+2CN-=2CO2+N2+2Cl- 稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 防止倒吸(或作安全瓶) 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O 加大氮气的通入量 酸式滴定管(或移液管) 淀粉溶液 溶液蓝色退去 0.04000
【解析】
(3) ClO2有强氧化性,容易氧化乳胶,量取ClO2溶液时,不可用碱式滴定管,可用酸式滴定管或移液管。标定ClO2浓度的思路为:ClO2将I-氧化成I2,再用Na2S2O3标准液滴定生成的I2,根据电子得失守恒、原子守恒有:2ClO2~2Cl-~10e-~10I-~5I2~10Na2S2O3,据此计算解答。
(1) ClO2将CN-氧化成CO2和N2,自身被还原为Cl-,结合电子得失守恒、原子守恒、电荷守恒可得离子方程式为:2ClO2+2CN-=2CO2+N2+2Cl-,故答案为:2ClO2+2CN-=2CO2+N2+2Cl-;
(2)①二氧化氯体积分数大于10%即可能发生爆炸,通入氮气除起到搅拌作用外,还可以稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸,故答案为:稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②ClO2极易溶于水,如果没有B,极易引起倒吸,所以B的作用是:防止倒吸(或作安全瓶),故答案为:防止倒吸(或作安全瓶);
③NaClO3作氧化剂、H2O2作还原剂,结合原子守恒、得失电子守恒可得方程式为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,故答案为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O;
④当看到装置C中导管液面上升,说明ClO2的含量偏高了,要加大氮气的通入量,以免爆炸,故答案为:加大氮气的通入量;
(3)ClO2有强氧化性,量取ClO2溶液时,可用酸式滴定管或移液管,ClO2将KI氧化成I2,再用Na2S2O3标准液滴定生成的I2,反应涉及碘单质,可用淀粉溶液做指示剂,I2遇淀粉溶液呈蓝色,当I2反应完时,溶液蓝色褪去。根据电子得失守恒、原子守恒有:2ClO2~2Cl-~10e-~10I-~5I2~10Na2S2O3,消耗0.1000 mol·L-1的Na2S2O3标准液20.00mL,即消耗Na2S2O3物质的量=0.1000 mol·L-1×20.00mL×10-3=2×10-3mol,由2ClO2~2Cl-~10e-~10I-~5I2~10Na2S2O3可知,n(ClO2)=![]() =
=![]() =4×10-4mol,c(ClO2)=
=4×10-4mol,c(ClO2)=![]() = 0.04000mol/L,故答案为:酸式滴定管(或移液管);淀粉溶液;溶液蓝色退去;0.04000。
= 0.04000mol/L,故答案为:酸式滴定管(或移液管);淀粉溶液;溶液蓝色退去;0.04000。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
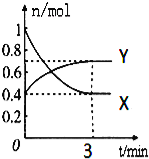
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.