题目内容
【题目】某化学兴趣小组欲测定某已部分变质的小苏打样品中Na2CO3的质量分数,设计如下实验方案。
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为_______________。
(2)实验中,需加热至恒重的目的是_______________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_______________。
(3)实验中判断沉淀是否完全的方法是_______________。
【方案三】按如下图所示装置进行实验:
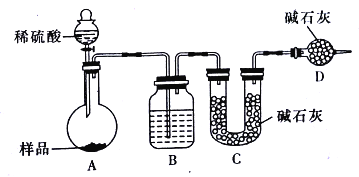
(1)D装置的作用是_______________。分液漏斗中_________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为________________(保留三位有效数字)
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存的在一个明显缺陷是________________。
【答案】 2NaHCO3![]() Na2CO3+CO2↑+H2O 保证NaHCO3分解完全 玻璃棒 取少量上层清液于一支洁净试管中,加一滴Ba(OH)2溶液,观察是否有白色沉淀生成 防止空气中的水蒸气、二氧化碳进入C裝置 不能 29.6% 缺少一个驱赶残留二氧化碳气体的装置(或其他合理答案)
Na2CO3+CO2↑+H2O 保证NaHCO3分解完全 玻璃棒 取少量上层清液于一支洁净试管中,加一滴Ba(OH)2溶液,观察是否有白色沉淀生成 防止空气中的水蒸气、二氧化碳进入C裝置 不能 29.6% 缺少一个驱赶残留二氧化碳气体的装置(或其他合理答案)
【解析】[方案一](1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,故答案为:保证NaHCO3分解完全;
[方案二](1)过滤时需用玻璃棒引流,故答案为:玻璃棒;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,故答案为:取少量上层清液于一支试管中,滴加Ba(OH)2溶液,观察是否有白色沉淀生成;
[方案三](1)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小,故答案为:防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
106g/mol×x+84g/mol×y=17.90g,44 g/mol×x+44 g/mol×y=8.80g,解得x=0.05 mol,y=0.15mol,则样品中Na2CO3的质量分数为![]() ×100%=29.6%,故答案为:29.6%;
×100%=29.6%,故答案为:29.6%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,故答案为:缺少一个驱赶残留二氧化碳气体的装置。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强 .
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .