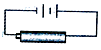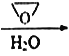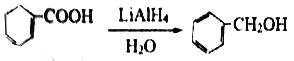��Ŀ����
����Ŀ����ͼ��ʾ����װ����XΪ�����ӽ���Ĥ�����ѵĽṹ��ʽΪCH3OCH3�� 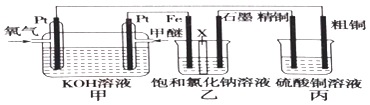
����Ҫ��ش�����������⣺
��1��д�������ĵ缫��Ӧ�� ��
��2������������Ҫ�������������ʯī�����������ɣ�
��3�������ͭ�к���п���������ʣ����ͭ�ĵ缫��ӦΪ���� ��
��4����Ӧһ��ʱ�䣬����ͭ��Һ��Ũ�Ƚ������������С�����䡱����
��5�����ڱ�״������2.24L�����μӷ�Ӧ����װ������������ͭ������Ϊ ��
��6��������װ�øij��ڱ�״���£���ʯī���缫������Ϊ2L��CuSO4��Һ��д�����CuSO4��Һʱ�����ӷ�Ӧ����ʽ��������ʵ�ʱ���Ͽ���Դ������ֻ�貹��22.2g����Cu2��OH��2CO3����ʹ���Һ�ָ���ԭŨ�����������ԭCuSO4��Һ��Ũ����mol/L����������Ƴ��ڶƼ��϶�ͭ��װ�ã�����θĶ������ü�Ҫ������������ ��
��7���������еĽ���Ĥȥ��������ֻ��H2�ݳ�������д���ҳ��з������ܷ�Ӧ�� ��
���𰸡�
��1��CH3OCH3��12e��+16OH���T2CO32��+11H2O
��2������
��3��Zn��2e��=Zn2+�� Cu��2e��=Cu2+
��4����С
��5��12.8g
��6��2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
��7��NaCl+H2O ![]() NaClO+H2��
NaClO+H2��
���������⣺��1����װ��Ϊȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ����������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OCH3��12e��+16OH���T2CO32��+11H2O��
�ʴ�Ϊ��CH3OCH3��12e��+16OH���T2CO32��+11H2O����2����װ��Ϊ����Ȼ���װ�ã����缫����ԭ��صĸ�����Ϊ���ص�������ʯīΪ�����������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ�������װ������������������Ҫ�����������ʴ�Ϊ����������3�������ͭ�к���п���������ʣ������ϲ���ͭ����п����ʧ���ӽ�����Һ������������ͭ���ӣ������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+���ʴ�Ϊ��Zn��2e��=Zn2+��Cu��2e��=Cu2+����4���ɣ�3�������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С��
�ʴ�Ϊ����С����5�����ݴ��������ת�Ƶ�������ȵ�������ͭ�Ĺ�ϵʽΪ��O2��������2Cu��������ͭ��������x��
O2������������ | 2Cu |
22.4L | 128g |
2.24L | x |
x=12.8g��
�ʴ�Ϊ��12.8 g����6����ʯī���缫������Ϊ2L��CuSO4��Һ����ͭ�����������ᣬ���ӷ���ʽΪ��2Cu2++2H2O ![]() 2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ����
2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ���� ![]() =0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ��ʴ�Ϊ��2Cu2++2H2O
=0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ��ʴ�Ϊ��2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O ![]() NaClO+H2�����ʴ�Ϊ��NaCl+H2O
NaClO+H2�����ʴ�Ϊ��NaCl+H2O ![]() NaClO+H2����
NaClO+H2����
��1����װ��Ϊȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����������ȼ��ʧ���ӷ���������Ӧ����2����װ��Ϊ����Ȼ���װ�ã����缫����ԭ��صĸ�����Ϊ���ص�������ʯīΪ����������������������������3����װ��Ϊ����ͭװ�ã�������Zn��Cu��Ag��������п��ͭ����������4������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С����5���ݴ��������ת�Ƶ�������ȵ�������ͭ�Ĺ�ϵʽΪ��O2����������2Cu���㣻��6����ʯī���缫������Ϊ2L��CuSO4��Һ����ͭ���������������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol������c= ![]() ���㣻��������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ�����������7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ݴ���д��
���㣻��������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ�����������7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ݴ���д��

 �߽�������ϵ�д�
�߽�������ϵ�д�