题目内容
下列解释实验事实的平衡不正确的是
| | 实 验 | 解释 |
| A | 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 | H2O H+ + OH- H+ + OH- |
| B | 0.1 mol/L CH3COOH的pH=3 | CH3COOH CH3COO- + H+ CH3COO- + H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3+ + 3OH- Fe(OH)3 Fe(OH)3 |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s)  Ba2+(aq) + SO42-(aq) Ba2+(aq) + SO42-(aq) |
C
解析试题分析:A、温度升高,H2O的电离平衡向右移动,正确;B、CH3COOH为弱酸,部分电离,存在电离平衡:CH3COOH  CH3COO?+H+,正确;C、配制FeCl3溶液时加少量盐酸,目的是抑制Fe3+的水解,Fe3++3H2O
CH3COO?+H+,正确;C、配制FeCl3溶液时加少量盐酸,目的是抑制Fe3+的水解,Fe3++3H2O Fe(OH)3+3H+,错误;D、用稀硫酸洗涤BaSO4,使BaSO4的沉淀溶解平衡:BaSO4(s)
Fe(OH)3+3H+,错误;D、用稀硫酸洗涤BaSO4,使BaSO4的沉淀溶解平衡:BaSO4(s)  Ba2+(aq) + SO42-(aq),向左移动,正确。
Ba2+(aq) + SO42-(aq),向左移动,正确。
考点:本题考查电离平衡、水解平衡、沉淀溶解平衡。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(NH4+)<c(Cl-)<c(H+)<c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
室温下,下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )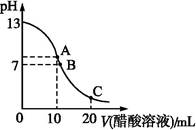
| A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
| A.V1>V2>V3 | B.V1<V2<V3 |
| C.V1=V2>V3 | D.V1=V2<V3 |
下列各溶液中,pH最大的是( )
| A.pH=9的氨水稀释1 000倍 |
| B.pH=9的烧碱溶液稀释1 000倍 |
| C.pH=5的盐酸稀释1 000倍 |
| D.pH=5的氯化铵溶液稀释1 000倍 |