题目内容
一定条件下,把3 mol N2和3 mol H2通入一个一定容积的密闭容器中,发生反应:
N2 (g)+3H2 (g) 2NH3(g)
2NH3(g)
达到平衡时,NH3的浓度为w mol·L-1,N2的转化率为m,则:
(1)H2的转化率________m(填“大于”“小于”“等于”或“无法确定”)。
(2)若在上述完全相同的容器中,维持温度不变,通入a mol NH3、b mol N2和c mol H2,要使达到平衡时,NH3的浓度仍为w mol·L-1。
若a=1,则b=________,c=________;b的取值范围为________。
(3)达到平衡时,H2和NH3均为1.5 mol,你认为是否可能?(填“可能”“不可能”或“无法确定”)。
N2 (g)+3H2 (g)
 2NH3(g)
2NH3(g)达到平衡时,NH3的浓度为w mol·L-1,N2的转化率为m,则:
(1)H2的转化率________m(填“大于”“小于”“等于”或“无法确定”)。
(2)若在上述完全相同的容器中,维持温度不变,通入a mol NH3、b mol N2和c mol H2,要使达到平衡时,NH3的浓度仍为w mol·L-1。
若a=1,则b=________,c=________;b的取值范围为________。
(3)达到平衡时,H2和NH3均为1.5 mol,你认为是否可能?(填“可能”“不可能”或“无法确定”)。
(1)大于(2)2.5 1. 5 2≤b≤3
(3)不可能
(3)不可能
(1)起始时N2与H2的物质的量相同,而转化时H2的物质的量是N2的3倍,所以,H2的转化率应大于m。
(2)a mol NH3完全分解生成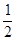 a mol N2和
a mol N2和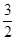 a mol H2,则
a mol H2,则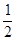 a+b=3,
a+b=3,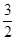 a+c=3。
a+c=3。
a=1时,b=2.5,c=1.5。
若3 mol N2与3 mol H2完全反应生成NH3,此时,剩余N2 2 mol。所以,b的取值范围为:2≤b≤3。
(2)a mol NH3完全分解生成
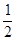 a mol N2和
a mol N2和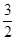 a mol H2,则
a mol H2,则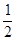 a+b=3,
a+b=3,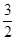 a+c=3。
a+c=3。a=1时,b=2.5,c=1.5。
若3 mol N2与3 mol H2完全反应生成NH3,此时,剩余N2 2 mol。所以,b的取值范围为:2≤b≤3。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
 2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为( )
2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为( ) B(g)+xC(g)
B(g)+xC(g) 2SO3达平衡后,通18O2气体,再次达平衡时,18O存在于( )
2SO3达平衡后,通18O2气体,再次达平衡时,18O存在于( ) xC(g)达到平衡后,C的体积分数为a%;若维持容器容积和温度不变,按起始物质的量A为0.6 mol,B为0.3 mol,C为1.4 mol充入容器中,达到平衡后,C的体积分数仍为a%,则x的值( )
xC(g)达到平衡后,C的体积分数为a%;若维持容器容积和温度不变,按起始物质的量A为0.6 mol,B为0.3 mol,C为1.4 mol充入容器中,达到平衡后,C的体积分数仍为a%,则x的值( ) 。随着CO2的继续通入,活塞又逐渐向右移动。
。随着CO2的继续通入,活塞又逐渐向右移动。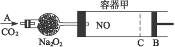
 2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= 。
2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= 。 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )